金沢大学ナノ生命科学研究所の華山力成教授,吉田孟史特任助教,医薬保健研究域医学系の土屋弘行教授,大学院医薬保健学総合研究科医学博士課程医学専攻の荒木麗博大学院生らの研究グループは,細胞外小胞(※1)による骨肉腫の進展(浸潤・転移)機構の解明に成功しました。
骨肉腫は小児・AYA世代(思春期・若年成人)に多い骨腫瘍で,現代においても転移例での5年生存率は10-20%と極めて予後不良な悪性腫瘍です。そのため,その進展機構の早急な解明と新規治療法の開発が望まれています。
今回,本研究グループは,腫瘍が分泌する細胞外小胞が,miRNA146a-5pという分子を腫瘍周辺のマクロファージ(前破骨細胞)へと送達することで破骨細胞(※2)への分化を阻害し,腫瘍が浸潤・転移を起こしやすい環境を構築することを見いだしました。
まず,腫瘍細胞を骨に移植した骨肉腫モデルマウスにおいて,腫瘍による細胞外小胞の産生を抑制した結果,血管新生や転移が抑えられることが分かりました。次に,腫瘍由来細胞外小胞がマクロファージ(前破骨細胞)に作用し,TRAF6の生成抑制及びNFκB経路のリン酸化抑制を通じて,破骨細胞への分化を阻害することを見いだしました。続いて、悪性度の異なる2種類のヒト骨肉腫細胞株におけるmiRNA(※3)の全網羅的解析を行った結果,高悪性度の細胞株に5倍以上多く含まれているmiRNA146a-5pが細胞外小胞によるTRAF6の生成抑制に関与し,マクロファージの破骨細胞への分化を阻害することを明らかとしました。さらに患者検体において治療前の生検組織で破骨細胞の分化が抑制されている症例では,有意に転移が多く予後不良であることが分かりました。
本研究により,骨肉腫の進展に細胞外小胞が深く関与しており,その産生を抑えることで,腫瘍の浸潤・転移を阻止できる可能性が示されました。今後,骨肉腫の早期発見や予後診断,新たな治療法の開発へと研究が発展することが期待されます。
本研究成果は,2021年5月4日にスイスの科学誌『Frontiers in Oncology』に掲載されました。
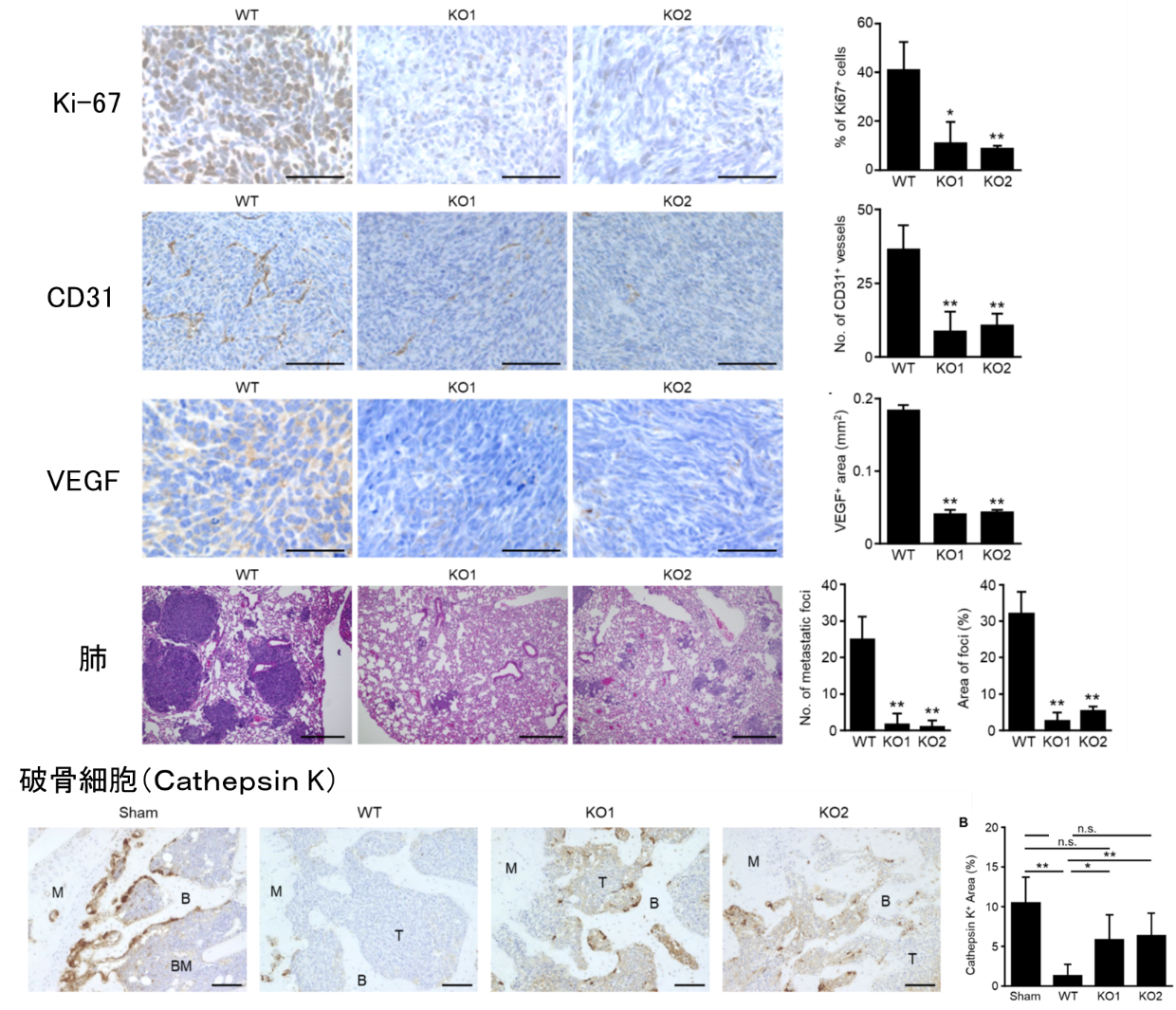
図1. 細胞外小胞の産生による骨肉腫の浸潤・転移
細胞外小胞の産生を低下させた骨肉腫細胞株(KO1,KO2)を樹立し,野生株(WT)と浸潤・転移能を比較した。KO1,KO2を下肢骨に移植したマウスでは,腫瘍細胞の分裂能(Ki-67),血管新生能(CD-31,VEGF),肺転移能は有意に減少した。また,骨微小環境において,WTによる腫瘍周辺の破骨細胞は有意に減少していたが,KO1,KO2による腫瘍周辺では維持されていた。
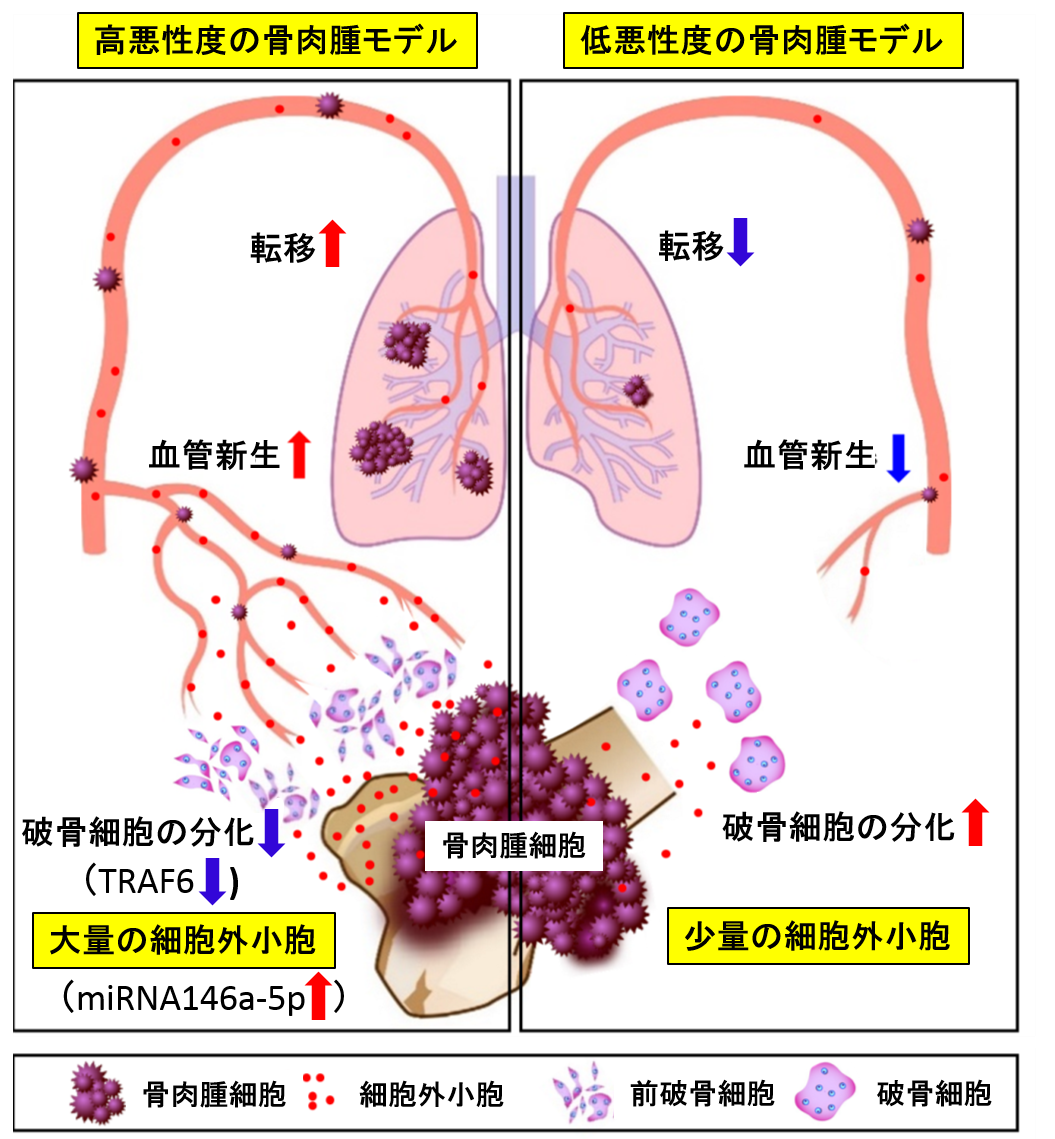
図2. 細胞外小胞による骨肉腫の浸潤・転移のモデル図
骨肉腫細胞内で生成された細胞外小胞中のmiRNA146a-5p分子が前破骨細胞に取り込まれると,TRAF6の生成を抑制して破骨細胞への分化を阻害する。その結果,腫瘍細胞による血管新生が増強し,転移が促進する。
【用語解説】
※1 細胞外小胞
細胞が分泌する脂質二重膜に覆われた小胞。分泌細胞由来のタンパク質やRNA,DNA,脂質などを含んでおり,さまざまな細胞間情報伝達を担っている。
※2 破骨細胞
異常な骨や古くなった骨の再構築のため,骨を吸収する役割を担う細胞。マクロファージ(前破骨細胞)が数個~数十個が融合・分化して形成される多核巨細胞。
※3 miRNA(マイクロRNA)
遺伝子ゲノム上にコードされ,多段階の生成過程を経て20から25塩基長で構成される微小RNA。機能性核酸であり,他の遺伝子の発現の調整を行うことで,生体内の現象に重要な役割を担っている。




 PAGE TOP
PAGE TOP