金沢大学がん進展制御研究所のニック・バーカーリサーチプロフェッサー,村上和弘助教らの研究グループは,組織幹細胞を可視化できるマウスから樹立した生体外3次元細胞培養体(オルガノイド ※1)を用いて,胃組織幹細胞の運命を決定する新たな遺伝子を発見しました。金沢大学がクロスアポイントメント制度(研究者が複数の機関に所属して研究に従事できる制度)を活用して,上皮幹細胞研究分野の世界的研究者であるニック・バーカー教授を招聘し,平成27年に金沢大学がん進展制御研究所にバーカー研究室を設置しました。以降,組織幹細胞の制御機構の研究で卓越した成果を挙げ続けています。
我々の体は無数の細胞から成り立ちます。これらの細胞は日々入れ替わり,生体組織を一定の状態に保っています。これら無数の細胞を供給する重要な役割を担うのが,自己増殖能と分化能を併せ持つ組織幹細胞です。しかし,生体内における詳細な解析は困難なため,胃組織幹細胞の幹細胞性(※2)を制御する分子機構は謎に包まれたままでした。
本研究では,生体内の組織構造・組織機能を模倣できるオルガノイドと,任意の遺伝子機能を破壊できるGenome-Scale CRISPR Knock-Out (GeCKO)スクリーニング法(※3)を組み合わせ,胃組織細胞の幹細胞性を制御する分子機構の詳細な解析を試みました。その結果,胃組織幹細胞の幹細胞性を制御する新たな遺伝子Alk,Bclaf3,Prkraをはじめて同定しました。
本研究成果は幹細胞制御の新しい概念につながる知見・技術基盤を提供するものであり,将来的には再生医療やがん治療の分野に革新をもたらすことが期待されます。
本研究成果は,2021年1月21日(米国東海岸標準時間)に米国科学誌『Proceedings of the National Academy of Sciences of the United States of America』のオンライン版に掲載されました。
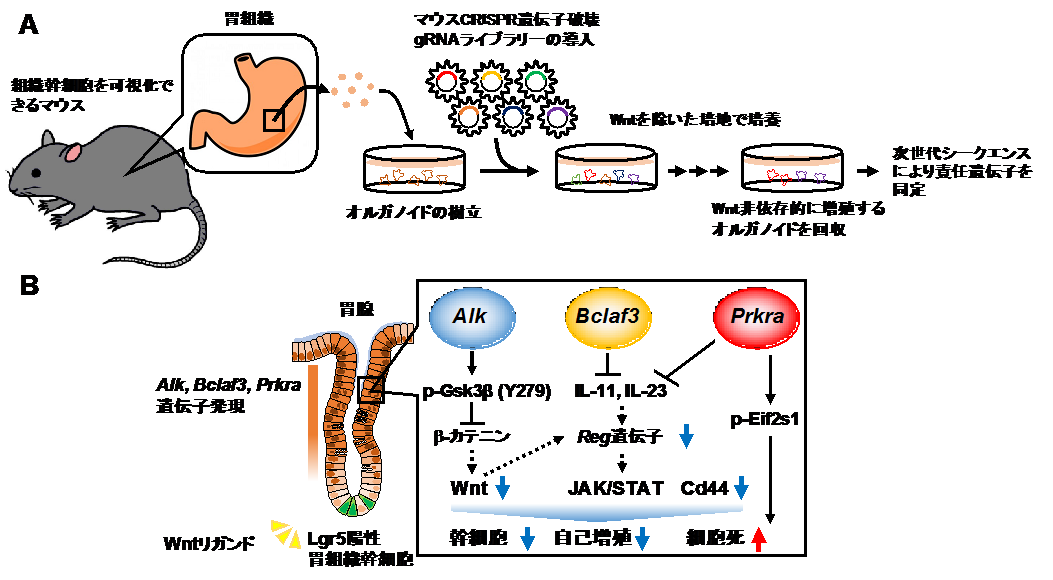
図. 本研究の概要
A. オルガノイドを用いたGeCKOスクリーニングの概要。組織幹細胞を可視化できるマウスから胃オルガノイドを樹立し,マウスCRISPR遺伝子破壊gRNAライブラリーを導入することで遺伝子をランダムに破壊する。その後,Wntシグナル(※4)非依存的に増殖するオルガノイドを回収し,次世代シークエンサーを用いて責任遺伝子を同定する。
B. 本研究で明らかになったこと。Alk,Bclaf3,Prkra遺伝子は胃腺の分化細胞で発現している。AlkはGSK3βをリン酸化することで不安定化しWntシグナルを抑制する。一方で,Bclaf3,Prkraは,インターロイキン(※5)11 (IL-11)および23(IL-23)の発現抑制を通して,胃上皮細胞の増殖に必須なReg遺伝子の発現を負に制御する。Alk,Bclaf3,Prkraが協調することで胃組織幹細胞の幹細胞性を決定していると考えられる。
※1 オルガノイド
組織や器官を生体内に類似した構造・機能を保ったまま生体外で培養できる3次元細胞培養体のこと。オルガノイドを用いることで,生体内に近い状態で組織を維持・観察できるため,医薬品候補の絞り込み,毒性試験,疾患の病態研究などへの応用が期待されている。
※2 幹細胞性
組織を形成するさまざまな細胞に分化する能力を保ちながら,細胞分裂によって自ら分裂できる性質。
※3 GeCKOスクリーニング法
すべての遺伝子に対応するガイドRNA (gRNA)が混ぜ合わされており,希釈して細胞に導入することで遺伝子をランダムに破壊できる。その後,目的の表現型を示す細胞集団を回収し,次世代シークエンサーを用いて破壊されている遺伝子を調べることで,目的の表現型を誘導する責任遺伝子を同定することができる。
※4 Wntシグナル
Wntタンパク質により活性化されるシグナル経路。細胞運命,増殖および遊走など個体発生における多種多様な細胞プロセスに重要な役割を果たしている。Wntシグナル経路に関連する遺伝子の変異は,さまざまな遺伝性がんと自然発生がんの両方に関与していることが知られている。
※5 インターロイキン
細胞間免疫応答の調節のためにリンパ球や単球,マクロファージなど主に免疫担当細胞が産生する生物活性物質。インターロイキン 11や23は胃上皮細胞からも分泌される。
Proceedings of the National Academy of Sciences of the United States of America
研究者情報:村上 和弘




 PAGE TOP
PAGE TOP