金沢大学ナノ生命科学研究所の中山隆宏准教授,紺野宏記准教授,古寺哲幸教授,安藤敏夫特任教授,理工学域自然システム学類4年(研究当時)の名和真衣佳さん,カリフォルニア大学ロサンゼルス校のデービッド・B・テプロフ教授,昭和大学医学部内科学講座脳神経内科学部門の小野賢二郎教授の国際共同研究グループは,パーキンソン病に特有なアミロイド線維を形成する原因タンパク質であるαシヌクレイン(※1)が同種間・異種間アミロイド線維(※2)を形成する状況の観察に成功し,これまで不明だった神経変性疾患におけるアミロイド線維構造を決定するメカニズムの一端を解明しました。
パーキンソン病やアルツハイマー病など,原因タンパク質のアミロイド線維形成を特徴とする神経変性疾患では,近年,アミロイド線維構造の違いと症状の違いとの関連が報告されています。加えて,患者個人の中でも,アミノ酸配列の一部が異なるバリアント(※3)が存在することも知られています。このような状況から,アミロイド線維の構造の決定・形成過程の解明が求められています。しかし,アミロイド線維の形成過程は多様な段階を含んでおり,個別の線維の形成・伸長過程を分析することは困難でした。
本研究では,高速原子間力顕微鏡(高速AFM,※4)を用いて,野生型と家族性パーキンソン病変異型αシヌクレインアミロイド線維が同種型・異種型の単量体αシヌクレインを取り込んで伸長する様子を個別の線維レベルで観察することに成功しました。その結果,同種型の単量体を取り込むときと比べて,異種型を取り込むときは,伸長速度が減速,停止あるいは加速するとともに,元の線維構造とは異なる構造で伸長することがあることを明らかにしました(図1)。
これらの知見は将来,パーキンソン病やレビー小体型認知症,アルツハイマー病の病態解明に寄与するとともに,他のアミロイドタンパク質のアミロイド線維多型形成のメカニズム解明に活用されることが期待されます。
本研究成果は,2020年7月17日(米国東部標準時)にアメリカ化学会誌『ACS Nano』のオンライン版にJust Acceptedとして掲載されました。
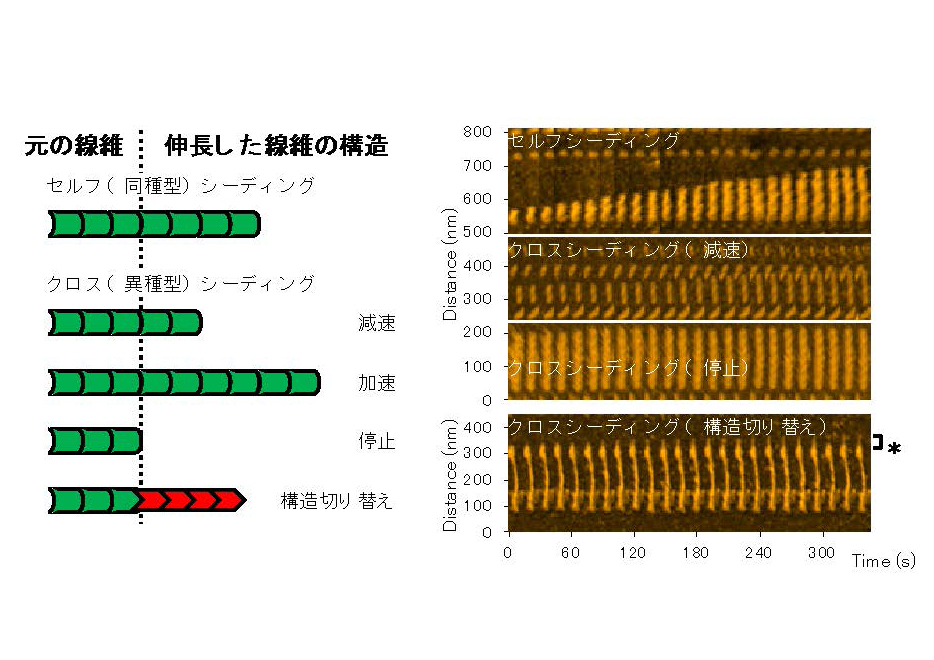
図1. αシヌクレインがつくるアミロイド線維の伸長の構造動態
左:模式図。元の線維が形成されたときの単量体と同じ単量体を取り込むとき(セルフシーディング),単量体は線維を鋳型として構造変化して線維端に結合し,線維が伸長する。元の線維が形成されたときの単量体と異なる種類の単量体を取り込むとき(クロスシーディング),セルフシーディングと比べて,伸長速度が減速,加速したり,伸長反応が停止したりする。さらに,元の線維と異なる構造で伸長することがある。
右:高速AFM像のキモグラフ(色の明るさはステージからの高さに相当)。αシヌクレインアミロイド線維は基本的には一方向に伸長した(図中の線維下端は伸長しにくく,上端が伸長)。各時間の上端を結ぶ直線の傾きが伸長速度に相当し,クロスシーディングでは伸長が減速あるいは停止した様子が分かる。さらに,元の線維とは異なる構造(図中*で示す部分)で伸長することがあることも明らかになった。
【用語解説】
※1 αシヌクレイン
140のアミノ酸が連なったタンパク質で,シナプス前終末や核をはじめとする細胞内の多様な部位に存在する。神経細胞の小胞輸送やシナプス機能の調節に関わるとされているが,その機能の全容は不明のままである。パーキンソン病,レビー小体型認知症,多系統萎縮症では,αシヌクレインが不溶性の線維の凝集塊であるレビー小体を形成するため,これらの疾患はαシヌクレイノパチーと呼ばれる。最近では細胞外のαシヌクレインも注目され,血液や脳脊髄液中のαシヌクレイン凝集体の測定が新たなバイオマーカーにつながる可能性がある。
※2 同種間・異種間アミロイド線維
アミロイドタンパク質は凝集してアミロイド線維の元となる核を形成し,核が単量体を取り込みながら線維に伸長する。このとき,核や線維は,自身を鋳型にして単量体を自身と同じ構造型に変えて線維に伸長する。鋳型となる核や線維をシードと呼ぶ。シードが形成されたときと同じ物理化学条件にある単量体を取り込んで伸長する線維を同種間アミロイド線維(セルフシーディングによる線維形成),異なる物理化学条件の単量体や異なるアミノ酸配列の単量体を取り込んで伸長する線維を異種間アミロイド線維(クロスシーディングによる線維形成)と呼ぶ。
※3 バリアント
同一種のタンパク質でも,遺伝子変異,翻訳後のタンパク質切断などによって,アミノ酸配列の異なるタイプが存在する。それらの総体をバリアントと呼ぶ。
※4 高速原子間力顕微鏡(高速AFM)
原子間力顕微鏡は,レコードプレーヤーの針がレコード盤の表面の形状をなぞるように,探針(プローブ)と試料間の相互作用を2次元に走査し,試料の起伏の画像を取得する顕微鏡。ナノメートル(10のマイナス9乗メートル)の空間分解能を持つことに加え,試料は真空中のみならず,空気中,液中と環境を選ばない。金沢大学の安藤敏夫特任教授の研究グループは,この原子間力顕微鏡の高速化に成功し,液中でのナノメートル空間分解ビデオ撮影を実現させ,蛍光などの標識無しでタンパク質などの生体分子の構造と動き(動態)を同時に観察することができるようになった。
研究者情報:中山 隆宏
研究者情報:紺野 宏記
研究者情報:古寺 哲幸
研究者情報:安藤 敏夫




 PAGE TOP
PAGE TOP