金沢大学ナノ生命科学研究所の安藤敏夫特任教授と微生物化学研究所,東京工業大学,理化学研究所,東京大学の共同研究グループは,細胞の恒常性維持に働くオートファジーを担う構造体の実体が,Atgタンパク質が液-液相分離(※1)した液体状の会合体(液滴(※2))であることを発見しました。
オートファジーは,有害なタンパク質凝集体や傷付いたミトコンドリアなどの分解を通して細胞の恒常性維持に働く細胞内の主要な分解経路であり,その異常は神経変性疾患やがんなどの重篤な疾病を引き起こすことが知られています。これまでに,約20種類のAtgタンパク質が集まってPAS(※3)と呼ばれる構造体を形成することが分かっていましたが,Atgタンパク質が集まる仕組みや形成された構造体の状態はよく分かっていませんでした。
本研究グループは,PASを構成するタンパク質の1つであるAtg13に着目し,蛍光顕微鏡解析によりPASの性質を明らかにするとともに,試験管内でPASを再構成することに成功しました。そして,PASはAtg13が他のAtgタンパク質と共に液-液相分離して形成された液滴の状態がその実体であり,この液滴がオートファジーを担うことを初めて明らかにしました。また,高速原子間力顕微鏡(※4)を活用することで,液滴に含まれるタンパク質の形状を観察することにも成功しました。
液-液相分離がオートファジーを直接制御していることを明らかにした本研究の結果は,液-液相分離が細胞内の生命現象全般に広く関与していることを示唆しており,さまざまな細胞内現象について分子機構の見直しが進むことが期待されます。さらに,オートファジーが関係する病気に関して,液-液相分離の制御に着目したオートファジー特異的な制御剤の開発が期待されます。
本研究成果は,2020年2月5日(英国時間)に英国科学誌『Nature』のオンライン速報版に掲載されました。
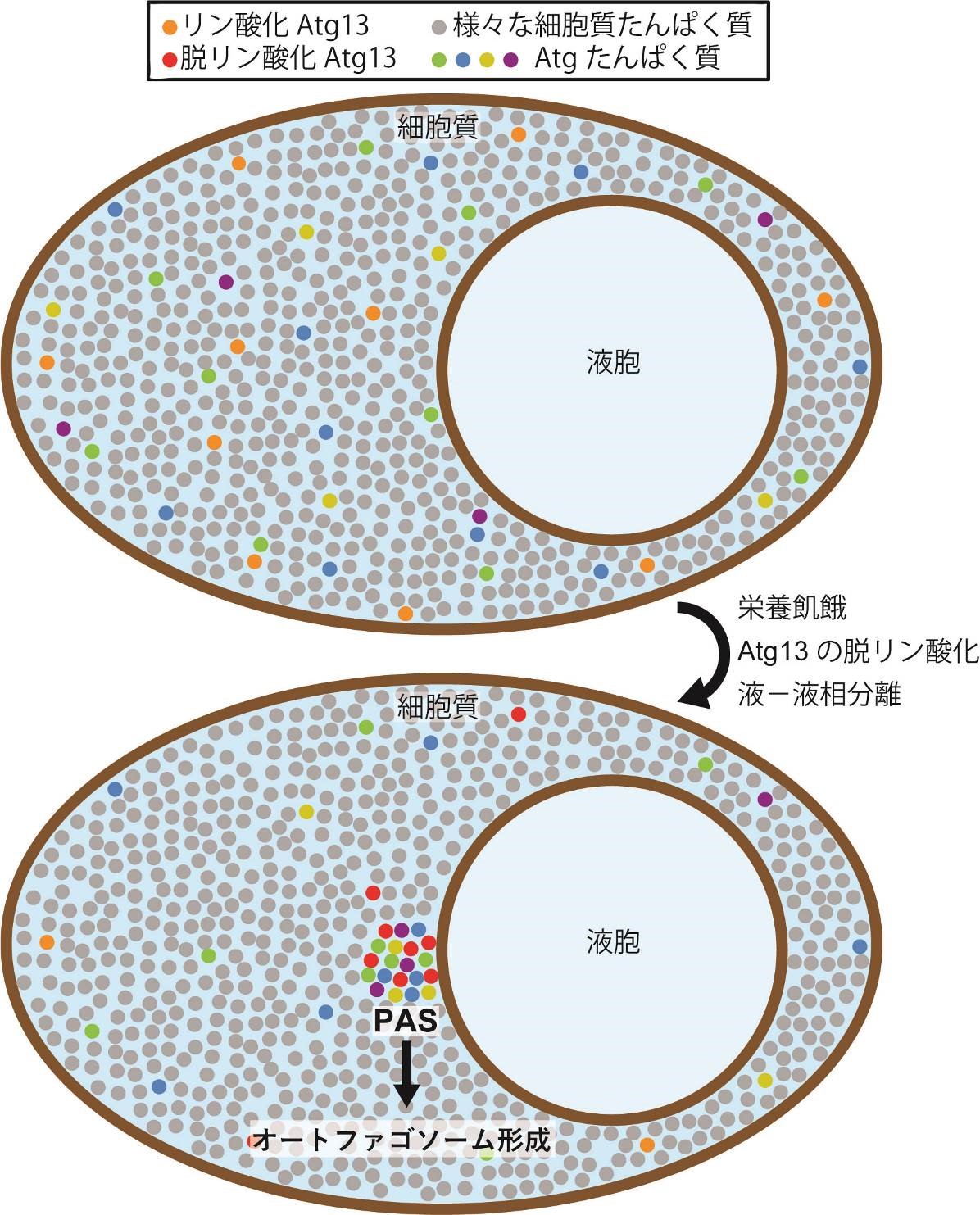
図1. 液-液相分離によるPASの形成モデル
栄養豊富な条件では,Atgタンパク質は細胞質中に分散しており,細胞質を満たしているさまざまなタンパク質と混ざり合っている。栄養飢餓になりAtg13が脱リン酸化されると,Atg13は他のAtgタンパク質と共に液-液相分離して液胞膜上に新たな液相(液滴)を形成する。この液滴がPASの実体であり,液滴からオートファゴソームの形成が進行する。
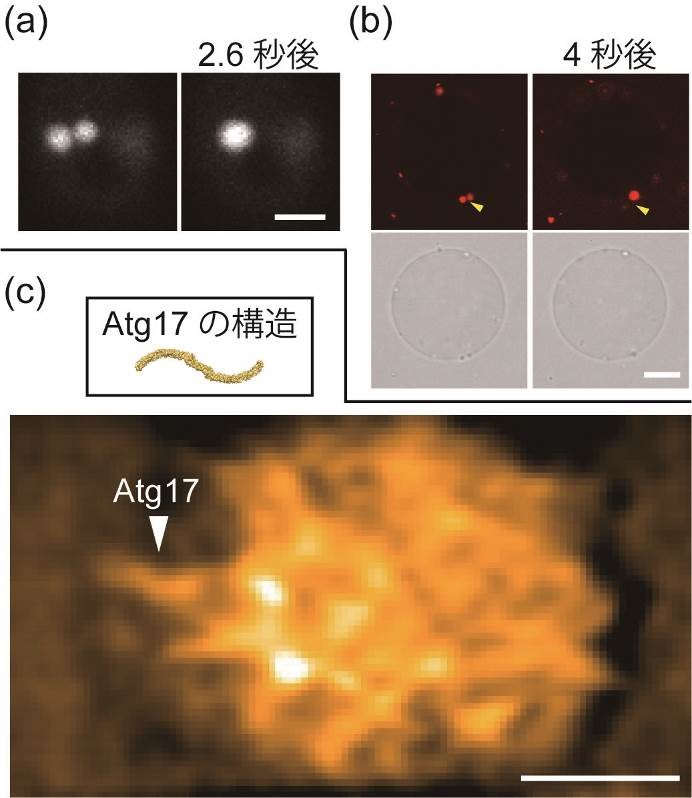
図2. PAS液滴の観察
(a)酵母細胞内でPAS同士が融合して球形になる様子。Atg13に融合させた蛍光タンパク質の蛍光で観察した(スケールバー:2マイクロメートル)。
(b)巨大リポソーム膜上でAtgタンパク質液滴が融合する様子。上の写真2枚はAtg13の蛍光像を,下の1枚は微分干渉像を示す(スケールバー:10マイクロメートル)。
(c)高速原子間力顕微鏡によるAtgタンパク質液滴の観察結果。液滴にはAtg17がランダムな向きで存在している様子が分かる。画像はFFTバンドパスフィルター処理を行っている(スケールバー:100ナノメートル)。
【用語解説】
※1 液-液相分離
均一な溶液が複数の液相に分離する現象であり,日常生活でも水と油の分離としてよく観察される。細胞内ではたんぱく質や核酸が液-液相分離することが知られている。
※2 液滴
タンパク質や核酸が液-液相分離することで形成した液体状の会合体。液滴は膜のないオルガネラとも呼ばれ,細胞内でさまざまな機能を担っている。液滴は自発的に球形になる性質があり,内部流動性が高く,周囲とも活発な分子交換を行うなどの性質を持つ。
※3 PAS(Pre-Autophagosomal Structure)
プレオートファゴソーム構造体の略。酵母において,栄養飢餓になると液胞近傍の1カ所にAtgタンパク質が集まるが,この集まった構造を呼ぶ。オートファゴソームはPASを起点として形成されると考えられている。
※4 高速原子間力顕微鏡(高速AFM)
原子間力顕微鏡(Atomic Force microscope: AFM)は,探針と試料の間に働く原子間力を元に分子の形状を可視化する顕微鏡である。高速AFMは溶液中で動いているタンパク質などの生体分子をナノメートルの空間分解能とサブ秒という時間分解能で観察することが可能である。
研究者情報:安藤 敏夫




 PAGE TOP
PAGE TOP