金沢大学がん進展制御研究所/新学術創成研究機構の土屋晃介助教らの研究グループは,呼吸器系におけるインフラマソーム(※1)に依存しない粘膜免疫の恒常性維持に関する新しいメカニズムを発見しました。
鼻と口から肺へと続く呼吸器系では,肺炎球菌やインフルエンザなどの微生物感染が疾患の原因となるため,その粘膜免疫が正常に機能することが非常に重要です。これまで,自然免疫機構の一種であるタンパク質複合体「インフラマソーム」が,caspase-1(※2)と呼ばれるタンパク分解酵素を活性化させることで炎症を引き起こし,感染防御を担っていることが知られていました。
本研究では,肺炎球菌の肺炎モデルを用いた感染実験により,本菌に対する防御には,caspase-1の活性化は必ずしも必要ではなく,インフラマソーム構成タンパク質であるASC とNLRP3が重要な役割を果たしていることが明らかになりました。また,遺伝子発現プロファイルによる解析の結果,その作用機序として,ASC とNLRP3がcaspase-1とは無関係に粘膜免疫の恒常性維持に働くことを突き止めました。
本研究によって,呼吸器の粘膜免疫の恒常性維持のための新しいメカニズムが確認されたことにより,気道における感染や炎症の制御につながることが期待されます。
本研究成果は,2019年7月5日(英国時間)に国際学術誌『Mucosal Immunology』のオンライン版に掲載されました。
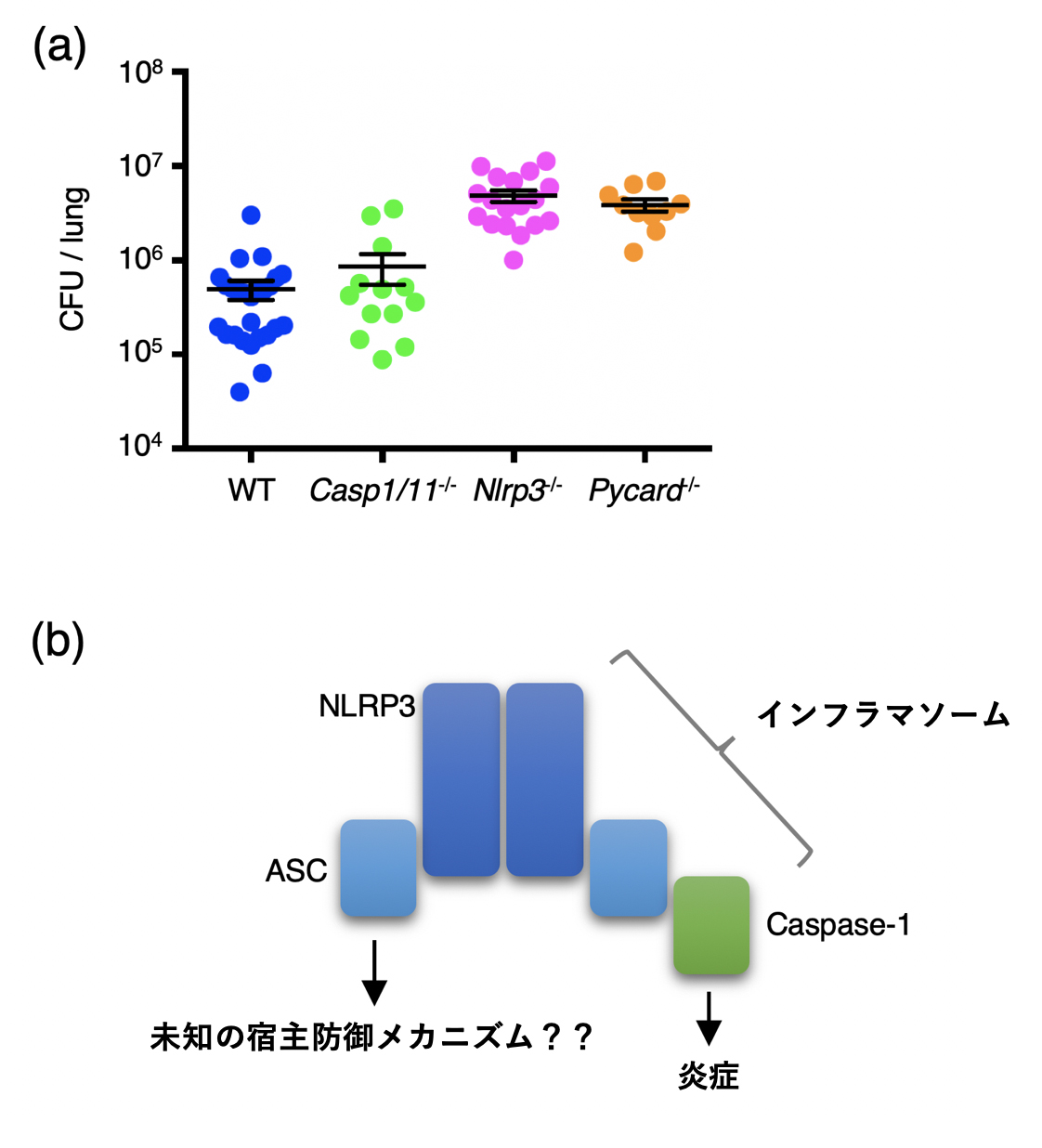
図1. 肺炎球菌に対する各遺伝子改変マウスの感染抵抗性
(a)野生型マウス(WT),caspase-1欠損マウス(Casp1/11-/-),NLRP3欠損マウス(Nlrp3-/-),およびASC欠損マウス(Pycard-/-)に肺炎球菌を経鼻感染させ,48時間後に肺内の菌数をコロニー法で測定した。野生型マウスとの比較において,NLRP3欠損マウスおよびASC欠損マウスでは有意な菌数の上昇が認められたが,caspase-1欠損マウスでは認められなかった。この結果から,肺炎球菌性肺炎への感染抵抗性にNLRP3とASCが必要である一方,caspase-1は必要ではないことが示唆された。
(b)NLRP3とASCはインフラマソーム形成を経てcaspase-1を活性化させることで炎症を誘導すると知られてきたが,(a)で得られた実験結果はNLRP3とASCが未知のcaspase-1非依存的なメカニズムを介して宿主防御に関わり得ることを示唆する。
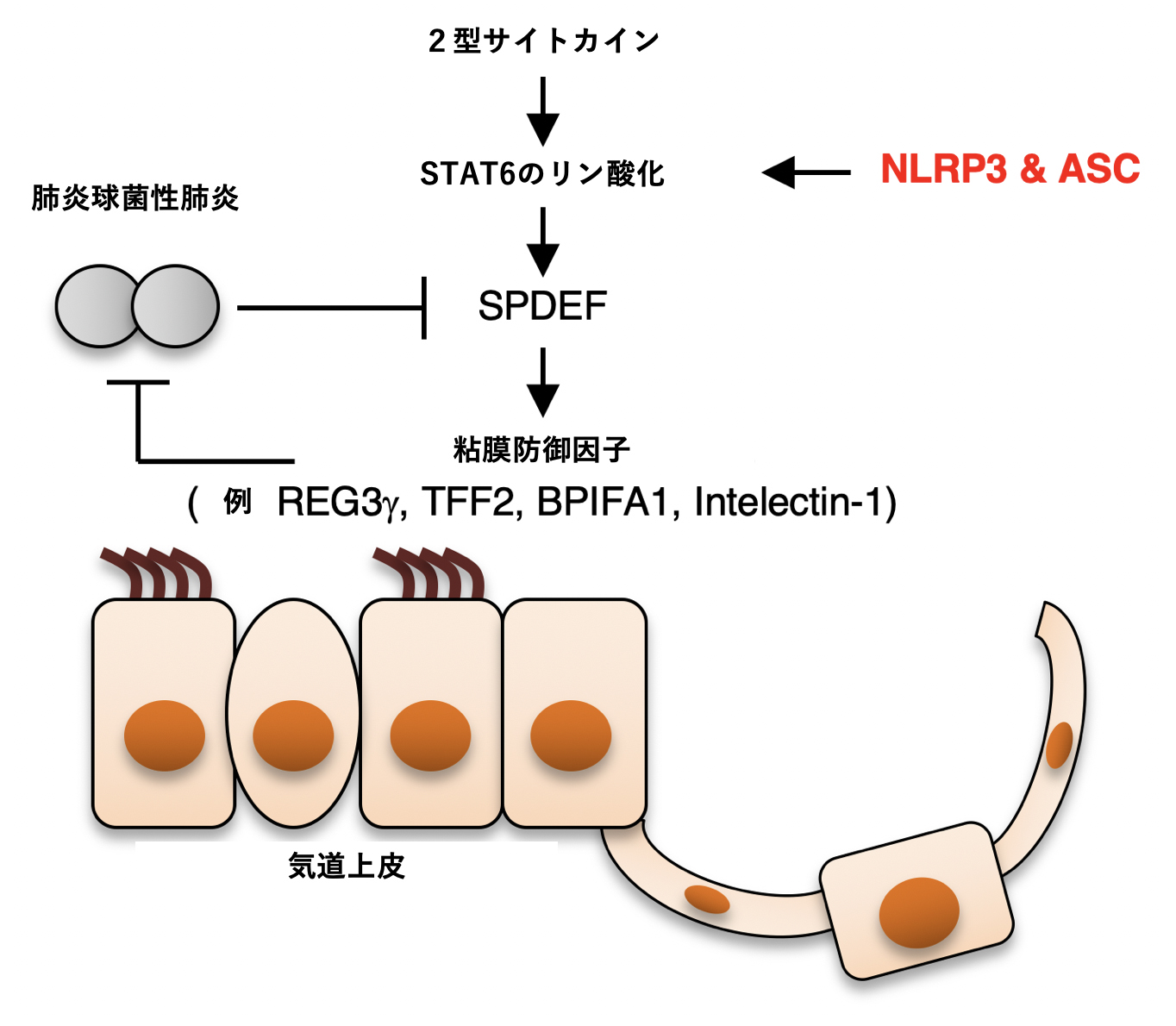
図2. 遺伝子発現プロファイル等で明らかになった肺炎球菌感染時の防御メカニズム
遺伝子発現プロファイルの結果から,肺炎球菌感染の際,気道におけるTFF2やインテレクチン-1のような粘膜防御因子の発現が,ASCとNLRP3によってcaspase-1非依存的に維持されることが分かった。さらに詳細な解析から,ASCとNLRP3は2型サイトカインによるSTAT6の活性化を促進することにより,粘膜防御因子の発現を正に制御する転写因子SPDEFの発現を維持することが明らかになった。すなわち,ASC とNLRP3によるcaspase-1活性化以外の新しい宿主防御メカニズムが同定された。
【用語解説】
※1 インフラマソーム
病原体の感染(異物)などに応答して細胞質に形成されるタンパク質の複合体。アダプタータンパク質であるASC が,NLRP3などの異物認識レセプターと未熟型caspasse-1といったタンパク質の会合を仲介し,それらが重合することによって形成される。Caspase-1を活性化させることで炎症や細胞死などの自然免疫応答を引き起こし,病原体への感染抵抗性に寄与する。
※2 Caspase-1
細胞質に存在し,インフラマソームで活性化されるタンパク質分解酵素。活性化されると特定の基質を切断することで細胞に自殺(細胞死)を誘導する。また,インターロイキン-1(IL-1)βやIL-18などの炎症誘導因子の未熟型(不活性型)を切断し,成熟型(活性型)に変換することで,炎症の誘導にも働く。
研究者情報:土屋 晃介




 PAGE TOP
PAGE TOP