金沢大学がん進展制御研究所/ナノ生命科学研究所の矢野聖二教授,福田康二助教,附属病院がんセンター/ナノ生命科学研究所の竹内伸司講師らの共同研究グループは,日本人の非小細胞肺がん患者の5%程度を占めるALK肺がん(※1)において分子標的薬(※2)にさらされた肺がん細胞が遺伝子変異および上皮間葉転換 (※3)を起こすことで,薬剤に対して耐性を獲得することを初めて明らかにしました。
がんの分子標的薬は,効果があった場合でも腫瘍の一部が薬剤に対して耐性化することで薬剤の効力が失われ,再発することが問題でした。特に,細胞が形質転換する上皮間葉転換は,がんの浸潤や転移と密接な関係があることから,これに起因する薬剤耐性獲得メカニズムを明らかにすることは,がん治療法の発展に重要です。
本研究グループは,ALK肺がん患者の腫瘍組織を解析した結果,遺伝子変異が起こっている領域と上皮間葉転換が起こっている領域の両方が独立して存在することを発見し,分子標的薬にさらされた腫瘍細胞が遺伝子変異と上皮間葉転換の2つの異なるメカニズムによって薬に耐性化することを解明しました。
さらに,がん細胞は遺伝子発現を制御するマイクロRNAのうちmiR-200cの発現を低下させることで上皮系から間葉系へと形質を変化させ,分子標的薬へ耐性化していることを突き止めました。そこで,動物実験においてmiR-200cの発現を上昇させる薬剤であるHDAC(ヒストン脱アセチル化酵素)阻害薬(※4) の一種キジノスタットで治療した後に分子標的薬を投与することで,腫瘍細胞を間葉系から上皮系へと戻し,分子標的薬への耐性を克服することに成功しました。
本研究成果は,分子標的薬の効果が得られなくなったALK肺がん患者の治療法の確立につながるものと期待されます。
本研究成果は,2019年2月8日(米国時間)に米国科学誌「Cancer Research」のオンライン版に掲載されました。
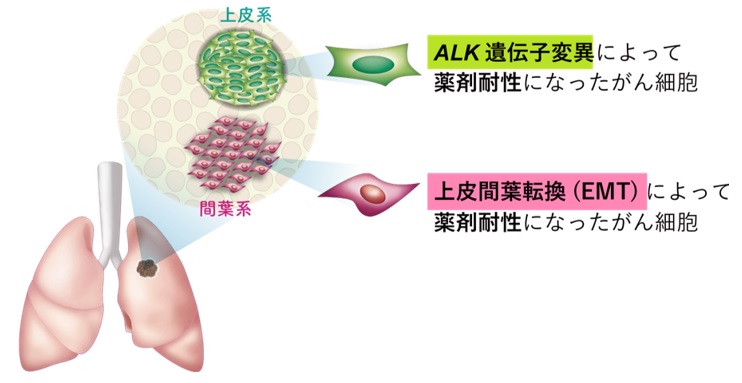
図1.
分子標的薬に耐性になったALK肺がん患者の腫瘍組織において,ALK遺伝子変異による耐性部位と,上皮間葉転換による耐性部位がそれぞれ存在する。
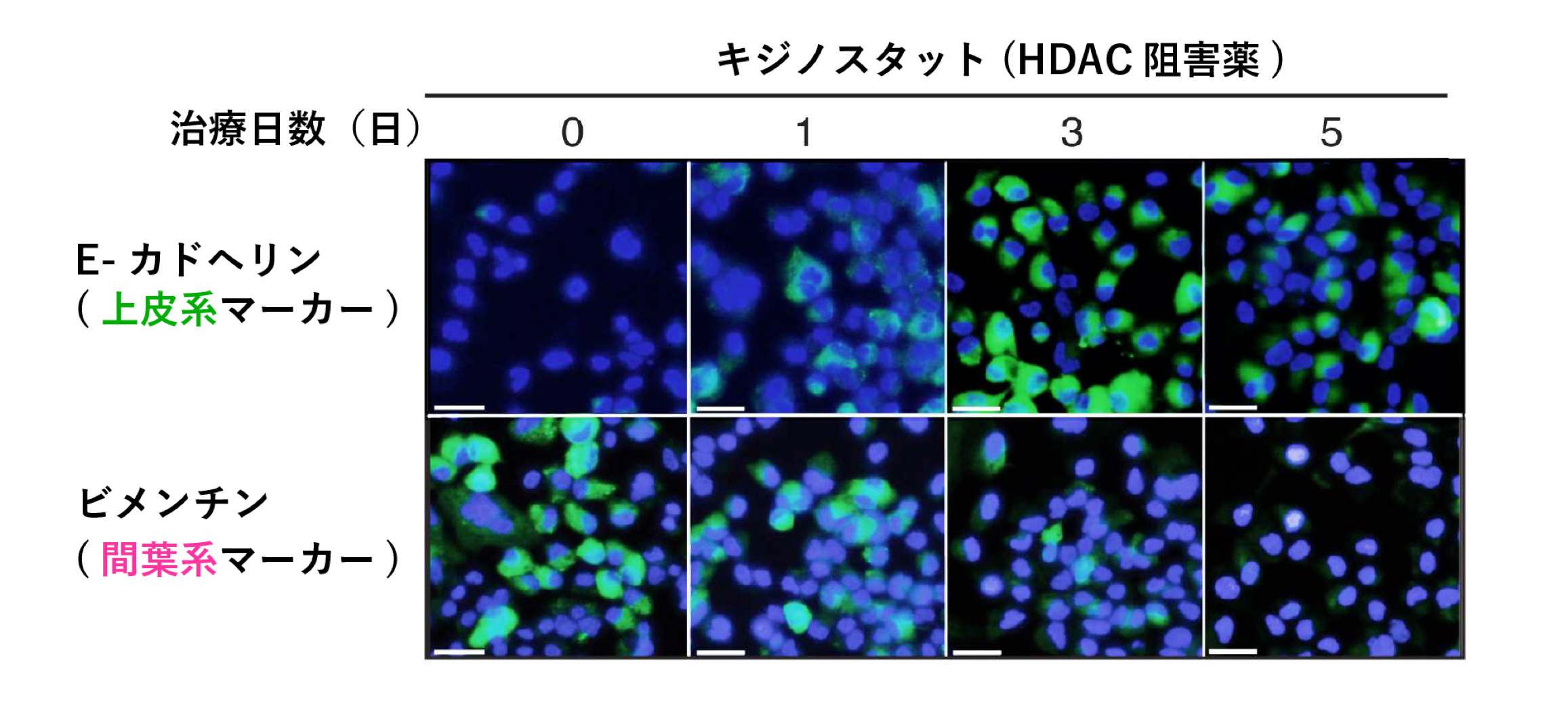
図2.
分子標的薬に耐性になったALK肺がん細胞おいて,キジノスタットで治療することで上皮系の回復を確認した。(上皮系マーカーが上昇,間葉系マーカーが低下)
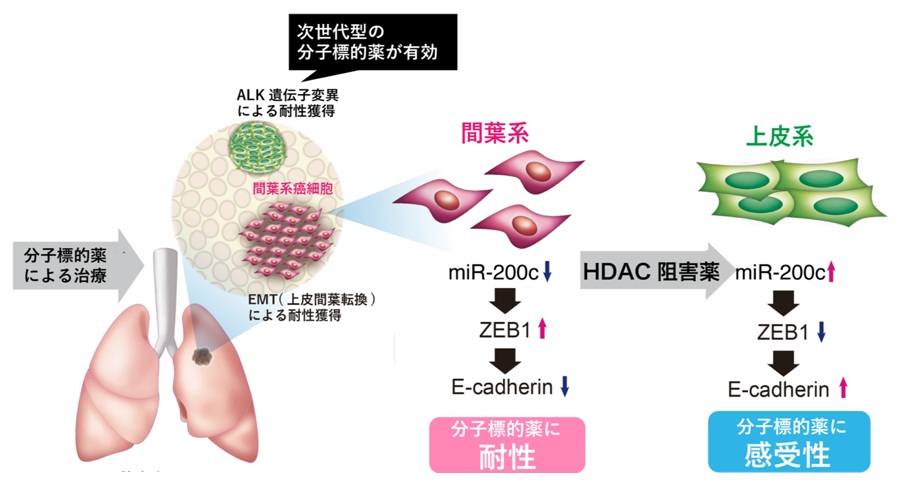
図3.
HDAC阻害薬で治療すると,miR-200cの発現上昇により間葉系のがん細胞は上皮系へと戻り,分子標的薬へ感受化できる。
【用語解説】
※1 ALK肺がん
ALK融合遺伝子陽性肺がん。ALK(未分化リンパ腫キナーゼ)の遺伝子がEML4などの他の遺伝子と融合することで生じる肺がんで,日本人の非小細胞肺がんの患者の約5%に認められる。ALK融合タンパクからのシグナルにより生存・増殖しており,これを抑制する分子標的薬であるALKチロシンキナーゼ阻害薬がよく効く。
※2 分子標的薬
がんの増殖や生存に重要な役割を果している分子にピンポイントで作用する薬。2001年に白血病に対するイマチニブ(商品名グリベック)と乳がんに対するトラスツズマブ(商品名ハーセプチン)が認可されたのを皮切りに,日本では現在40種類以上の分子標的薬ががんに対して認可されている。
※3 上皮間葉転換
細胞極性や周囲細胞との細胞接着機能を有する上皮系細胞が,その機能を失って,浸潤能を得ることで間葉系細胞へと変化するプロセス。がんの転移や薬剤耐性獲得との関連が報告されている。
※4 HDAC(ヒストン脱アセチル化酵素)阻害薬
ヒストンとはDNAを巻き取っているタンパク質であり,HDACが作用することにより,がん細胞の分裂や,細胞の形態を調整する遺伝子の発現を抑制する。多発性骨髄腫細胞ではHDAC活性の異常な上昇が認められており,HDAC阻害薬を使うことで抗腫瘍効果が期待されている。
・ 詳しくはこちら
・ 研究者情報:矢野 聖二
・ 研究者情報:福田 康二
・ 研究者情報:竹内 伸司




 PAGE TOP
PAGE TOP