金沢大学ナノ生命科学研究所安藤敏夫特任教授と能代大輔博士研究員は,高速原子間力顕微鏡(高速AFM)(※1)を用いて,変性したタンパク質を正常な状態に戻す機能を持つ分子機械(※2)であるGroEL-GroESの動的な相互作用を直接観察し,詳細な反応機構の解明に初めて成功しました。また,その高効率な反応機構を支えるGroELの2つのリング間のコミュニケーションの解明にも成功しました。
細菌で機能するシャペロン(※3)GroELは,シャペロンの補助因子であるコシャペロニンGroESと連携して,変性したタンパク質分子を正常な構造へと戻す機能(シャペロニン機能)を持ちます。GroELは七量体サブユニットから成るリング2つが背中合わせに結合した分子で,14個のサブユニットそれぞれがATP(アデノシン3リン酸)(※4)を分解します。GroESは単一のリングで,GroELのヌクレオチド状態に依存してGroELリングの端に結合します。GroELのリング内側には変性した基質タンパク質を結合する空洞があり,GroESの結合はその空洞に蓋をすることになります。このように,GroELの14個のATP, 2つのリング,基質タンパク質,GroESといった複数の因子があるため,シャペロニン反応がどのように進行するかを解明することはこれまで困難でした。
今回,本研究では,高速AFMを用いて,GroELの2つのリングで動的に起こるGroESの結合と解離を直接観察しました(図)。その結果,GroELとGroESとの結合・解離の反応パターンとそれぞれの反応ステップの反応速度を精密に測定することに成功しました。
今後,シャペロニン反応の作用機構を解明する上でも極めて重要な研究成果です。
本研究成果は,2018年5月7日(英国時間)に英国科学誌「Philosophical Transactions of the Royal Society B」のオンライン版に掲載されました。
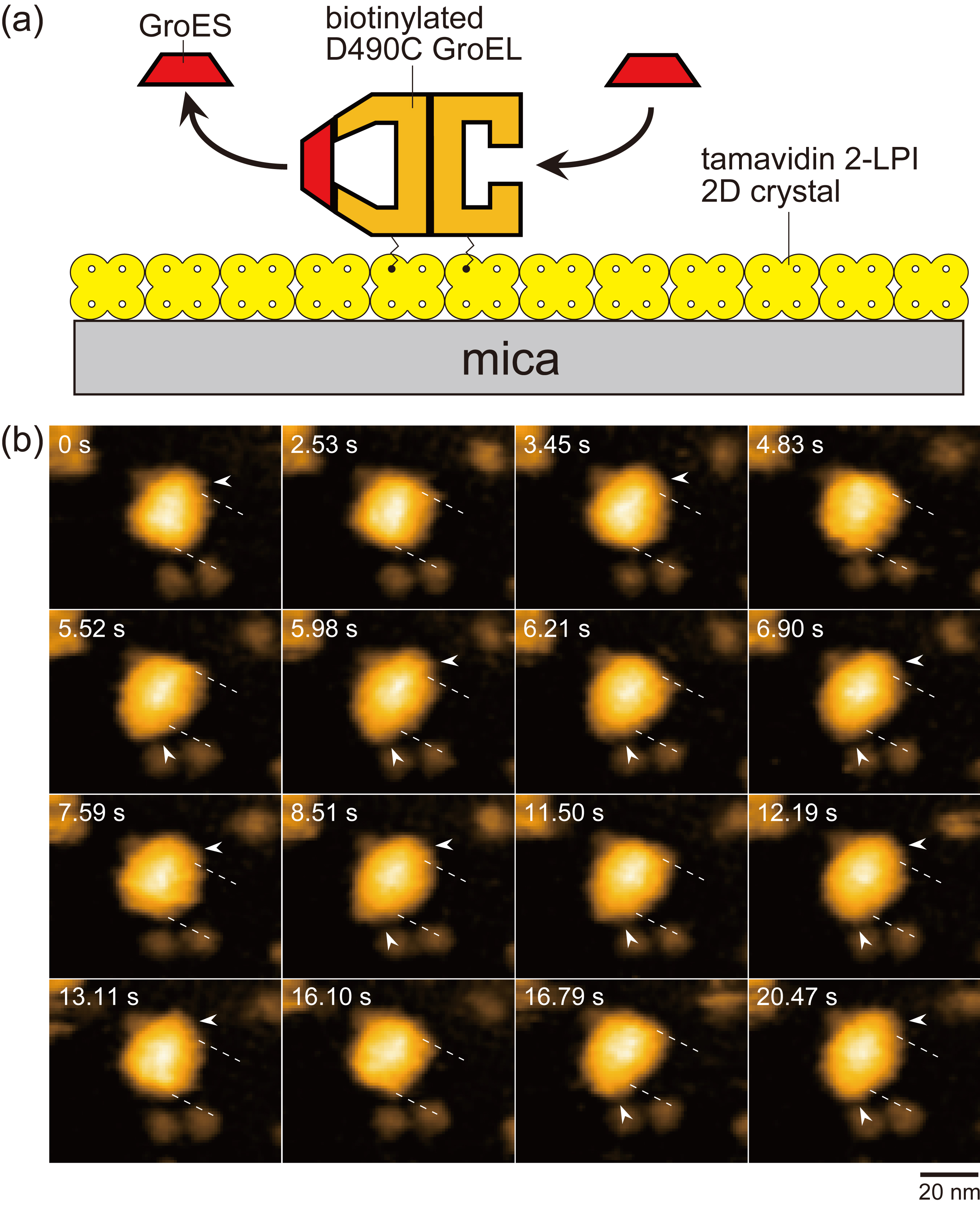
図. 動的なGroEL–GroES相互作用の模式図(a)とGroELの2つのリングで起こるGroESの結合と解離を示す高速AFM像(b)
【用語解説】
※1 高速原子間力顕微鏡(高速AFM)
非常に微細な先端を持つ探針で試料表面を高速に走査し,高さの変化として個々のタンパク質の構造変化を実時間で観察する手法。
※2 分子機械
化学エネルギーを機械的な動きに変換し,その動きによって機能を発揮するするタンパク質やタンパク質複合体。
※3 シャペロン
変性状態のタンパク質に結合して,適切に折りたたまれた状態になって機能を獲得するのを助けるタンパク質の総称。
※4 ATP(アデノシン3リン酸)
2つの高エネルギーリン酸結合を持ち,これを切断することで,タンパク質などの他の分子に,機能を発揮させるためのエネルギーを供給する物質。生体内でのエネルギーの貯蔵や輸送に用いられる。
・ 詳しくはこちら
・ Philosophical Transactions of the Royal Society B
・ 研究者情報:安藤 敏夫




 PAGE TOP
PAGE TOP