金沢大学新学術創成研究機構ナノ生命科学研究所古寺哲幸教授,安藤敏夫特任教授らの研究グループは,大阪大学,名古屋大学および九州大学の研究グループと共同で,高時間高空間分解能で生体分子の反応や構造変化の観察が可能な高速原子間力顕微鏡を用いて,細菌べん毛タンパク質輸送の交通整理のしくみを世界で初めて明らかにしました。
サルモネラ属菌はべん毛と呼ばれる運動器官を使って最適な環境へ移動します。べん毛は,回転モーターとして働く基部体,ユニバーサルジョイントのフック,らせん型プロペラである繊維の,3つの部分構造で構成されます(図1)。べん毛基部に存在する独自のタンパク質輸送装置(※1)は,フックの構築中にはフックタンパク質を輸送し,フックの長さが55 nmに到達すると,輸送装置はフックタンパク質の輸送を停止し,繊維形成に関わるタンパク質の輸送を開始します。これまでに,フックの長さを測定するしくみや,フックの完成に伴って起こるタンパク質輸送装置の基質特異性(※2)の切り替わるしくみについては詳細に解析されてきました(図2)。しかし,輸送装置が輸送するタンパク質の種類を切り替える,いわば輸送の交通整理のしくみは長い間謎のままでした。
今回,本共同研究グループは,べん毛タンパク質輸送装置の構成タンパク質であるFlhAの細胞質ドメイン(※3)を高速原子間力顕微鏡で解析することにより,世界で初めてFlhAが9量体リング(※4)を形成するとともに,FlhAリングの構造変化によりタンパク質輸送装置の基質特異性が変化することを解明しました(図3)。
本研究成果は,べん毛タンパク質輸送の交通整理のしくみの解明への第一歩になるとともに,細菌感染症に関わるFlhAホモログ(※5)を直接ターゲットとした細菌感染症薬のスクリーニングへの応用が期待されます。
本研究成果は,米国科学誌「Science Advances」に,4月26日午前3時(日本時間)に公開されました。
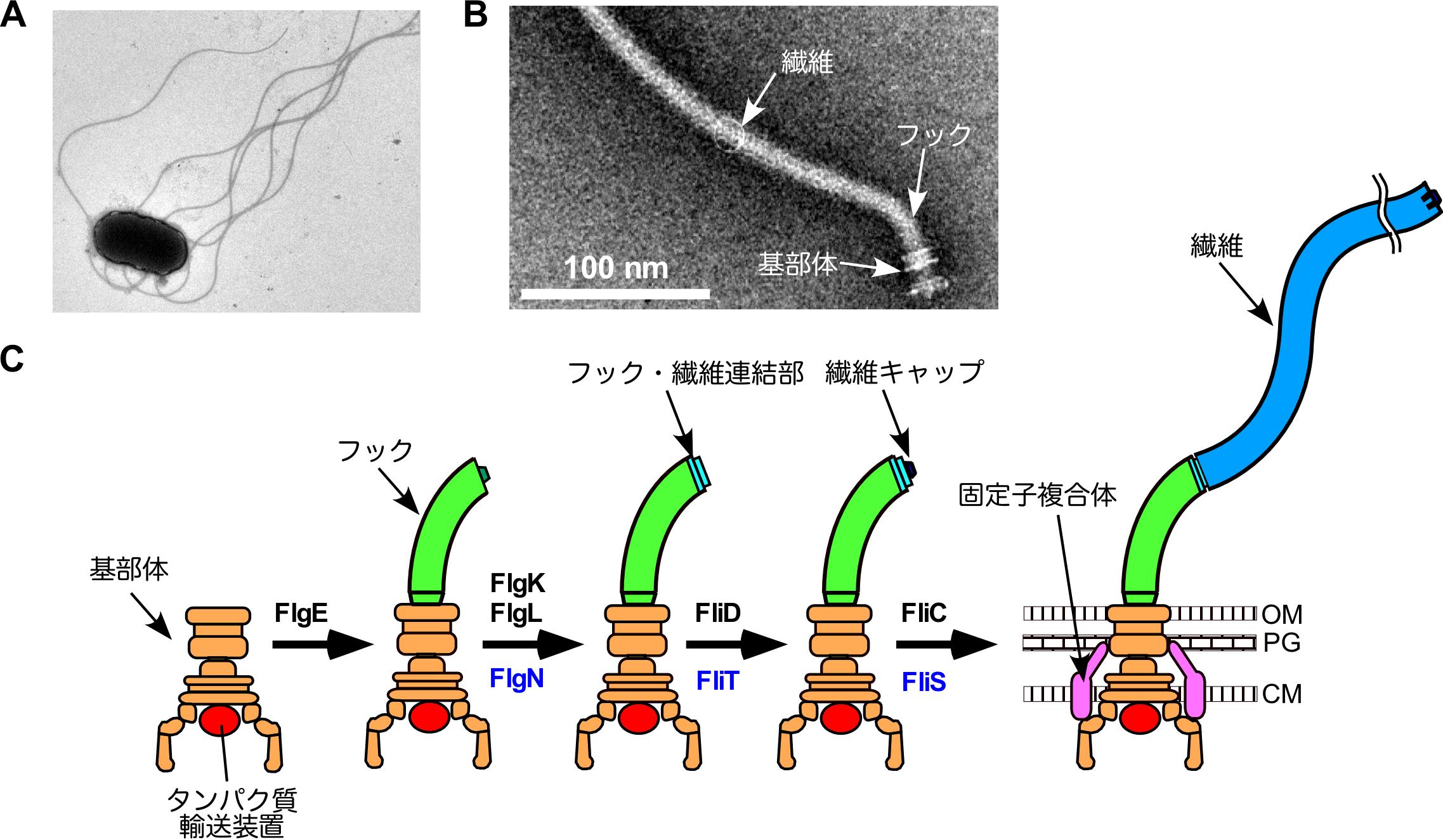
図1 細菌べん毛の構造
(A) サルモネラ属菌の電子顕微鏡写真。
(B)サルモネラ属菌から単離精製された電子顕微鏡写真。
(C)べん毛の構築過程.OMは外膜,PGはペプチドグリカン層,CMは細胞膜を示す。
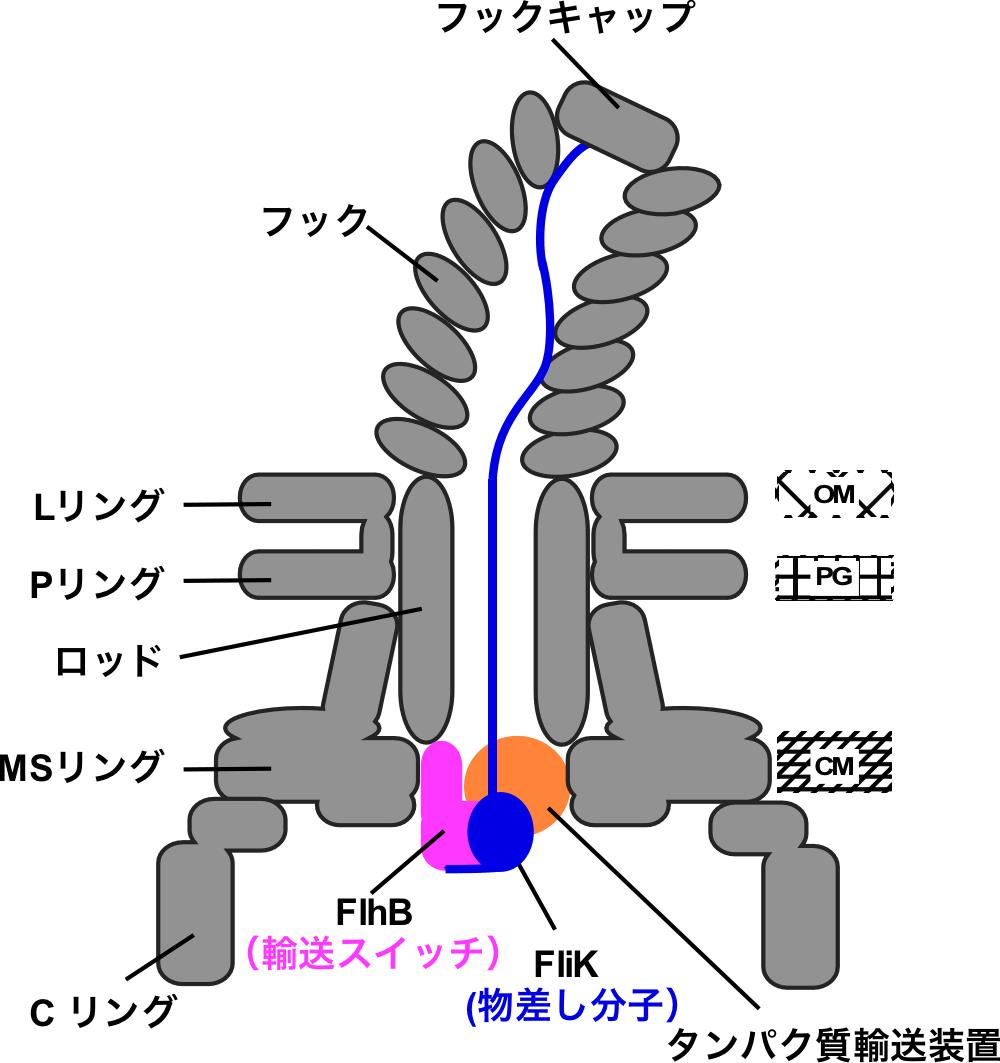
図2 一時的に形成されるフック完成シグナリング複合体の模式図
時折細胞外に送り出されるFliKがフックの長さを測定する分子物差しとして働く。フックの長さが55 nmになると,FliKのC末ドメインが輸送スイッチであるFlhBと相互作用し,その結果タンパク質輸送装置の基質特異性が切り替わる。
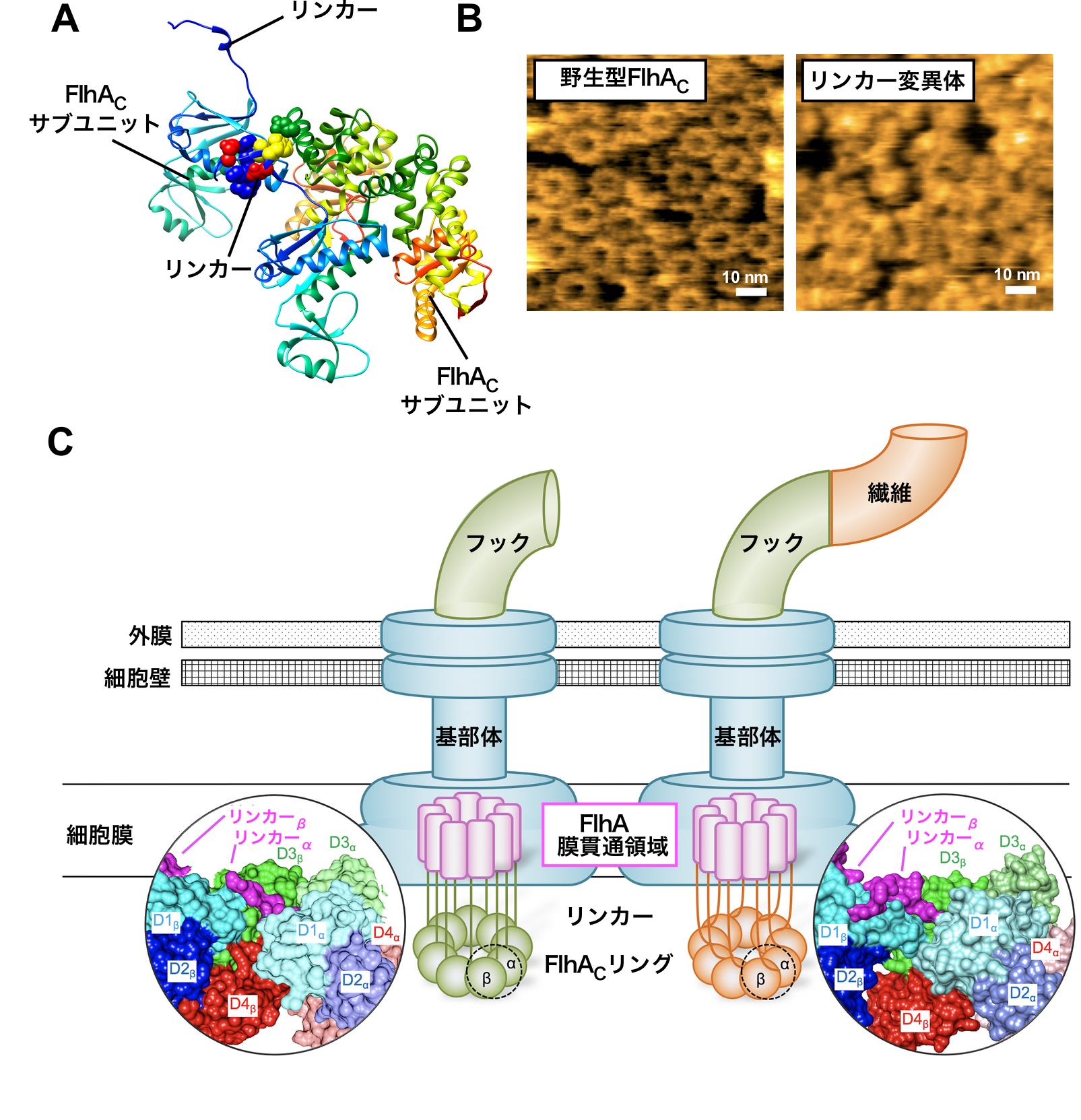
図3 FlhAのリング形成
(A)FlhAの結晶構造.結晶中でリンカー領域が隣のFlhAC分子に結合している様子。
(B)FlhACリングの高速原子間力像。リンカーが欠失されると(右),リング形成が著しく阻害される。
(C)FlhACリング構造のリモデリング仮説。FlhAのリンカー領域がFlhACサブユニットに結合すると,FlhACリングの構造が変化し,その結果フックタンパク質の輸送が停止して繊維タンパク質の輸送が開始する。
【用語解説】
※1 タンパク質輸送装置
生体膜を透過させてタンパク質を細胞外へ送り出す装置。
※2 基質特異性
生体分子が特定の物質だけを認識して生体反応を引き起こす現象。
※3 細胞質ドメイン
膜タンパク質のドメイン(コンパクトな立体構造を作り,独立に折りたたまれて安定化されている)の内,細胞質側に位置するもの。
※4 9量体リング
9個の分子が環状に集合した構造体。
※5 ホモログ
進化系統樹で共通の祖先から派生した相同性の高い遺伝子のグループ。




 PAGE TOP
PAGE TOP