–
–
【本研究成果のポイント】
① 高速原子間力顕微鏡(HS-AFM)(※1)で、エストロゲン受容体α(ERα)の構造変化やDNA結合過程を、1分子レベルでリアルタイム観察することに世界で初めて成功。
② ERαはエストロゲンの有無にかかわらずDNAに結合できるが、エストロゲン存在下でより安定に結合することを発見。
③ 「リガンド誘導型二量体化(LID)モデル」というホルモン応答性転写制御の新たな概念を提唱。
金沢大学大学院新学術創成研究科ナノ生命科学専攻/ナノ精密医学・理工学卓越大学院プログラム履修生の西出梧朗(博士後期課程3年、研究当時)、九州大学大学院理学研究院の松島綾美教授、金沢大学ナノ生命科学研究所(WPI-NanoLSI)/新学術創成研究機構のリチャード・ウォング教授らの共同研究グループは、高速原子間力顕微鏡(HS-AFM)を用いて、エストロゲン受容体α(ERα)(※2)がDNA上のエストロゲン応答配列(ERE)を認識・結合する瞬間をリアルタイムで可視化することに成功しました。
エストロゲン受容体αは、乳がんなどホルモン依存性がんの発症や進行に深く関与しており、これまでにDNA結合ドメイン(DBD)やリガンド結合ドメイン(LBD)といった部分的構造の解析が進められてきました。しかし、フルレングスのERαがどのようにしてDNA上のエストロゲン応答配列(ERE)を認識・結合し、転写活性化を引き起こすかについては、未解明な点が多く残されていました。本研究では、ERαがエストロゲン(リガンド)の有無にかかわらずEREに結合できること、特にリガンド存在下ではより高精度かつ安定した二量体形成を行い、DNA結合位置の特異性や持続性が著しく向上することを明らかにしました。また、ERαがDNA上を滑るように動きながらEREを探索する「動的サーチ機構」の存在も実証されました。これらの知見をもとに、本研究グループは「リガンド誘導型二量体化(Ligand-Induced Dimerization: LID)モデル」を提唱しました。これは、エストロゲンの結合がERαの構造安定化とDNA認識の精密化に寄与し、結果として転写活性の効率的な誘導につながるという新たな概念です。本研究成果は、エストロゲン依存性がんの新たな治療戦略の設計においても重要な手がかりを提供するものであり、今後の分子腫瘍学・ホルモン治療の進展に寄与することが期待されます。
本研究成果は、2025年4月18日(協定世界時)に米国化学会の学術雑誌『ACS Nano』のオンライン版に掲載されました。
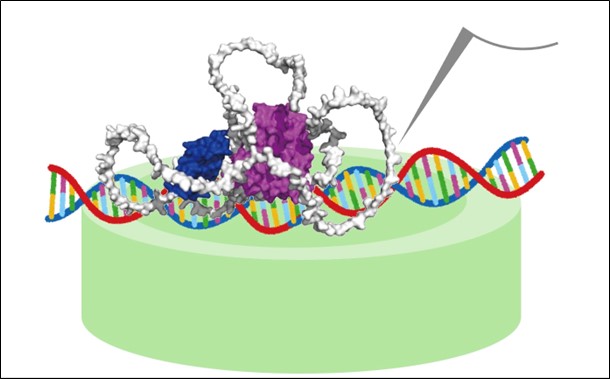 図1:高速原子間力顕微鏡(HS-AFM)によるERαとDNAの相互作用の可視化概念図
図1:高速原子間力顕微鏡(HS-AFM)によるERαとDNAの相互作用の可視化概念図
本図は、HS-AFMによって観察された、エストロゲン受容体α(ERα:紫および青)とDNA(赤と青緑)との相互作用を模式的に示したものである。ERαは柔軟な構造をもつ領域(白)を介してDNA上を探索し、特異的なエストロゲン応答配列(ERE)に結合する。HS-AFMの探針(上部の灰色)により、DNA上でのERαの動的な構造変化や二量体形成の過程がリアルタイムで捉えられた。図下の緑色の円柱は、観察に使用された雲母基板を表している。© Nishide et al., 2025. 出典:ACS Nano。 American Chemical Society より許可を得て掲載。CC BY-NC-ND 4.0
図2:ACS Nano の表紙
© Nishide et al., 2025. 出典:ACS Nano。 American Chemical Society より許可を得て掲載。CC BY-NC-ND 4.0
【用語解説】
※1:高速原子間力顕微鏡(HS-AFM)
探針と試料の間に働く原子間力を基に、分子の形状やその動態をナノメートル(10-9m)程度の空間分解能と、サブ秒という時間分解能で可視化することができる顕微鏡。
※2:エストロゲン受容体α(Estrogen Receptor alpha:ERα)
エストロゲン受容体α(Estrogen Receptor alpha, ERα)は、女性ホルモンであるエストロゲンに応答する核内受容体の一種で、細胞内で遺伝子の発現を制御する転写因子として働きます。エストロゲンがERαに結合すると、ERαは核内に移行し、DNA上のエストロゲン応答配列(ERE)に結合して標的遺伝子の転写を活性化します。乳がんなどのホルモン依存性がんにおいて、重要な役割を果たすことから、がん研究や創薬の主要な標的として注目されています。
–
ジャーナル名:ACS Nano
研究者情報:リチャード・ウォング(Richard Wong)




 PAGE TOP
PAGE TOP