金沢大学ナノ生命科学研究所(WPI-NanoLSI)のアイハン・ユルトセベル特任助教と福間剛士教授らの研究グループは,アメリカ・ワシントン大学の研究グループと共同で,グラファイト固体表面におけるペプチドの自己組織化構造を,液中周波数変調原子間力顕微鏡(FM-AFM)(※1)により分子レベルで可視化することに成功しました。これにより,グラファイトに対するペプチドの分子認識の一端が解明されました。
生体要素の一種であるペプチドは,操作・設計・利用の容易さから,ナノバイオデバイスとしての利用が模索されています。ペプチドの性質のさらなる向上や実用化のために,その構造や挙動,機能を分子レベルで明らかにすることが望まれています。しかしながら,従来はこれらを直接解析できる計測技術がなく,その詳細はよく知られていませんでした。
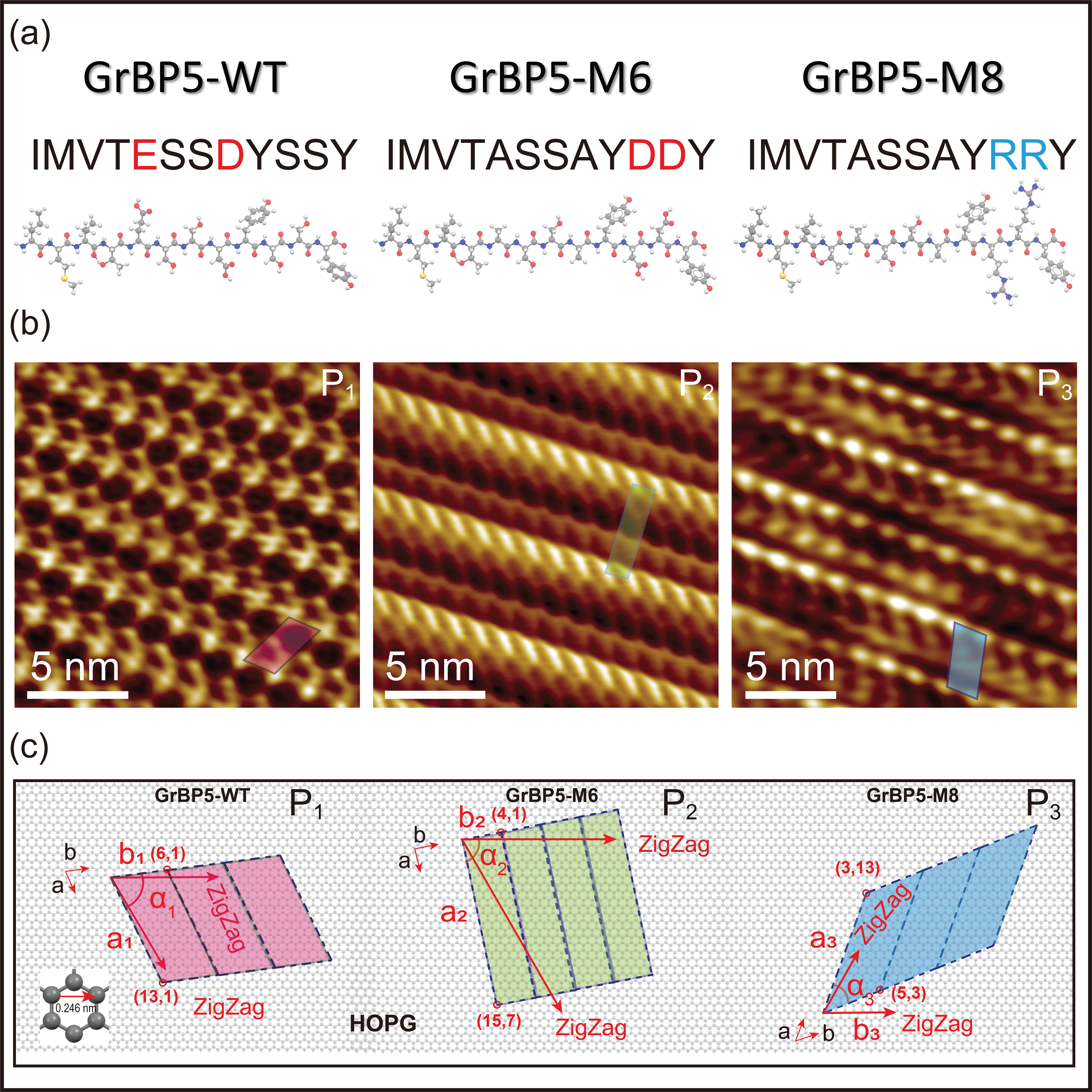
本研究では,金沢大学のグループがこれまでに開発した,物質の表面構造を分子スケールで観察できる FM-AFM を用いて,2 種類の変異ペプチドを水の中で観察し,その表面を分子レベルで可視化することに成功しました。これらのペプチドは, 逆の電気的性質を有するにもかかわらず,いずれもグラファイト表面に吸着構造を形成し,加えてグラファイト表面の原子スケール構造に応じて,これらのペプチドが異なる吸着構造をとることを明らかにしました。さらに,分子動力学シミュレーションによる解析と組み合わせることで,他の生体システムでは見られないような生体/固体のハイブリッド界面を形成することを初めて明らかにしました。
これらの知見は,ナノバイオ/固体界面の設計に向けた重要な一歩であり,分子基盤デバイスの多様性を飛躍的に広げることが期待されます。
本研究成果は,2024 年 2 月 22 日に国際学術誌『Small』のオンライン版に掲載されました。
(a)本研究成果で利用したペプチドの化学構造。GrBP5-WT:野生型。GrBP5-M6:変異体,負に帯電している。GrBP5-M8:変異体,正に帯電している。(b)規則的に並んでいるペプチド結晶の高分解能 AFM 像。(c)グラファイト(0001)面の炭素原子に形成するペプチド結晶の結晶学的配向関係。© 2024 Yurtsever, et al., Small published by Wiley-VCH GmbH
【用語解説】
※1:原子間力顕微鏡(AFM)
先端が非常に鋭く尖った探針で観察対象をなぞることにより,その探針の動きから表面の凹凸を反映した画像を取得する顕微鏡。真空中・大気中・水中などのありとあらゆる環境下において原子・分子レベルの構造を捉えることが可能である。特に金沢大学ナノ生命科学研究所の福間剛士教授が開発した FM-AFM は,液中において原子分解能観察が可能な唯一の技術である。
ジャーナル名:Small




 PAGE TOP
PAGE TOP