⾦沢⼤学ナノ⽣命科学研究所の古寺哲幸教授は,新潟⼤学⼤学院(⻄⼭晃史講師,松本壮吉教授),京都⼤学複合原⼦⼒科学研究所(清⽔将裕助教),九州⼤学⽣体防御医学研究所(眞栁浩太講師[現・同⼤学⼤学院薬学研究院]),⼤阪公⽴⼤学(⼭⼝雄⼤助教[現・国⽴感染症研究所]),新潟⼤学⼤学院⾃然科学研究科(伊東孝祐准教授)との共同研究で,抗酸菌の天然変性ヒストン様タンパク質 mycobacterial DNA-binding protein 1(MDP1)が,他の核酸結合タンパク質では報告のない,天然変性領域(※1)を介した新規の DNA 凝集メカニズムを介して抗酸菌の休眠を誘導することを明らかにしました。
本研究成果は,2023年12月4日,科学誌『Nucleic Acids Research』に掲載されました。
【本研究成果のポイント】
- 結核や⾮結核性抗酸菌(NTM)症などの抗酸菌症は,難治性であり,投薬期間は半年から年単位に及ぶ。この根底に,休眠して薬剤パーシスター(※2) 化する抗酸菌の性質があるが,休眠期に誘導される分⼦の解析が盛んに⾏われてきた中で,実際に休眠を誘導する分⼦は報告されていなかった。
- 結核は⼈類史上最も多くの⼈命を奪ってきた。2022 年の死亡者数は 157 万⼈に上った。休眠結核菌による潜伏感染(潜在性結核)( ※3)は世界⼈⼝の 1/4 におよぶとされ,活動性結核の主要な発⽣源である。休眠菌は多くの薬剤にも抵抗性で,⻑期投薬を要する元凶である。
- 抗酸菌のヒストン様タンパク質は,細菌では希なヒストンに似た天然変性領域を持ち,その作⽤で休眠を誘導する。
- 本研究グループでは,⾼速原⼦間⼒顕微鏡(⾼速 AFM)(※4)によるタイムラプス撮影と,分⼦動⼒学計算を組み合わせることによって,MDP1 の天然変性領域が両⾯テープのように2本の DNA ⼆重らせんを貼り合わせていくという,他の核酸結合タンパク質では報告されていない,新規の DNA 凝集メカニズムを解明した。
- MDP1 の天然変性領域は,抗酸菌と⼀部のストレス耐性菌に特徴的で,強⼒な休眠誘導活性を持っていた。本研究成果は,未知であった抗酸菌の休眠誘導の決定的なメカニズムを明らかにした。また本成果は,休眠菌にも有効で,既存薬との交差耐性が無い薬剤の開発にも繋がることが期待される。
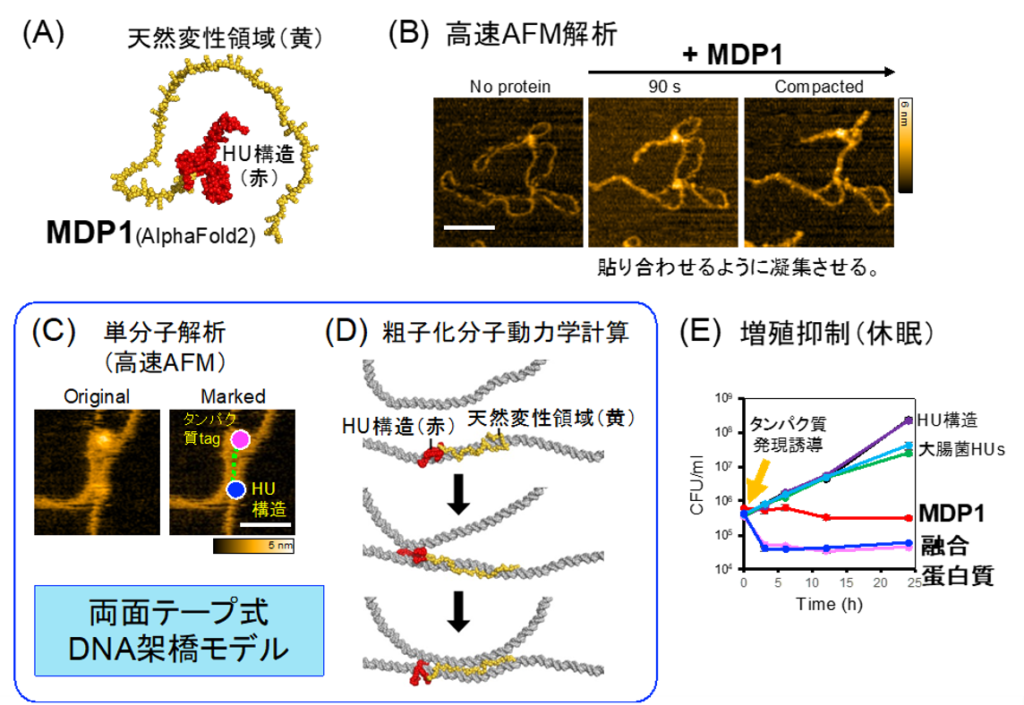
図1. MDP1による天然変性領域依存的なDNA架橋・凝集作用
A. MDP1の構造。AlphaFold2で予測。赤色はHU構造(単量体)。黄色は天然変性領域。
B. 高速AFMでタイムラプス撮影したMDP1のDNA凝集過程。
C, D. 天然変性領域による両面テープ式DNA架橋モデル。Tag融合タンパク質を用いた観察(C)と粗子化分子動力学計算による再現(D)。
E. MDP1天然変性領域を介した抗酸菌の増殖抑制作用。
【用語解説】
※1:天然変性領域
⼀部のタンパク質の内部(または全体)に存在する領域。アミノ酸配列の低複雑性や偏ったアミノ酸組成のために⼀定の⽴体構造をとることができず,まるで変性しているかのように振る舞う。近年,さまざまな細胞機能(クロマチン制御等),疾患(アルツハイマー病,筋萎縮性側索硬化症(ALS)等)に関与していることが報告されている。
※2:薬剤パーシスター
⼀定数の感受性菌を薬剤で処理しても,死滅せずに⼀部の菌が⻑期間⽣存する場合がある。このような,薬剤に低感受性を⽰す⼀群を薬剤パーシスターと呼ぶ。慢性感染症や感染症の再燃などに関連する。
※3:潜在性結核
結核菌に感染しているが,菌の休眠などにより結核を発病しない状態。
※4:⾼速原⼦間⼒顕微鏡(⾼速 AFM)
探針でなぞることでステージ上の物質の表⾯構造を画像化する解析装置。⽔溶液中の⽣体⾼分⼦(タンパク質,核酸など)の構造・動きをナノメーター,1 秒以下の時空間解像度でタイムラプス撮影することが可能。
ジャーナル名:Nucleic Acids Research
研究者情報:古寺 哲幸




 PAGE TOP
PAGE TOP