金沢大学ナノ生命科学研究所/新学術創成研究機構の角野歩助教,中国・復旦大学生命科学学院の服部素之教授らの共同研究グループは,辛みや熱の受容体であるTRPV1(※1)チャネルの活性化に伴う構造揺らぎの変化を高速原子間力顕微鏡(高速AFM)(※2)で一分子計測することに成功しました。
TRPV1は,43℃以上の熱やトウガラシに含まれるカプサイシンなどの辛み成分の受容体です。TRPV1の活性化の際の構造的な揺らぎの変化が活性化の調節に重要である可能性が理論的研究により示唆されていましたが,これまでTRPV1の揺らぎを実験により直接可視化することはできておらず、この受容体の詳細な動作機構に関しては不明点が残されていました。
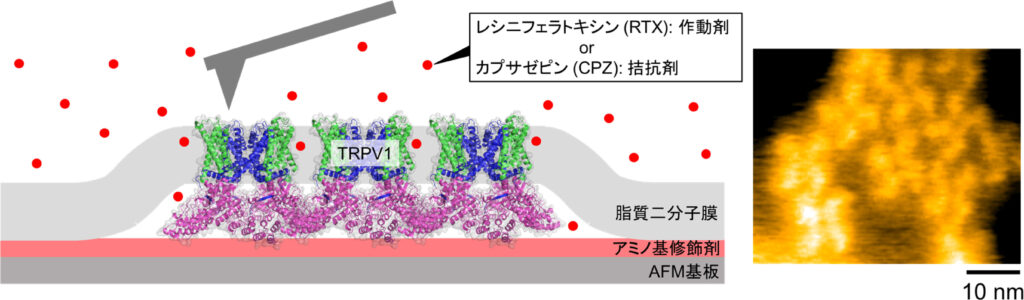
本研究では,高速AFMにより,レシニフェラトキシン(RTX:作動剤,カプサイシンの1000倍の辛さ)とカプサゼピン(CPZ:拮抗剤)が結合した際,また,それらが結合していない場合のTRPV1チャネルの1分子構造揺らぎを,高速AFMを用いることにより,直接可視化することに成功しました。何も結合していない状態に比べて,RTXが結合すると構造揺らぎが増強され,一方でCPZが結合すると揺らぎが抑制されることがわかりました。このような活性化状態に関連した構造揺らぎの変化は,TRPV1の動作に重要な役割を果たすと考えられます。これらの知見は将来,辛みや熱の知覚の生理現象分子メカニズムの解明や,その情報をもとにした鎮痛剤の開発に活用されることが期待されます。
本研究成果は,2023年5月8日(米国東部時間)に米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』に掲載されました。
【用語解説】
※1:TRPV1: transient receptor potential vanilloid member 1
細胞膜に存在し,辛み成分や43℃以上の温度を感知して細胞内にカチオンを流入させるイオンチャネル型受容体。日本語名称は一過性受容体電位カチオンチャネルサブファミリーVメンバー1。
※2:高速原子間力顕微鏡(高速AFM)
柔らかい板バネの先に付いた針の先端で試料に触れ,試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより,試料の表面形状を可視化する。また,試料の表面を高速(最速33フレーム/秒)にスキャンすることにより試料の動きを可視化することができる。
© 2023 Sumino, et al., PNAS
図:TRPV1チャネルの高速AFM観察の模式図(左)と,AFM像(右)
ジャーナル名:Proceedings of the National Academy of Sciences of the United States of America(PNAS)
研究者情報:角野 歩




 PAGE TOP
PAGE TOP