金沢大学医薬保健研究域医学系脳神経内科学の小野賢二郎教授,ナノ生命科学研究所の中山隆宏准教授は,昭和大学薬理科学研究センターの辻まゆみ教授らとともに,アルツハイマー病(AD)(※1)の発症原因と考えられているアミロイドβタンパク質(Aβ)の凝集体に,新規根本的治療薬である抗アミロイドβ抗体レカネマブが結合していく様子を,高速原子間力顕微鏡(高速AFM)(※2)で捉えることに世界で初めて成功しました。
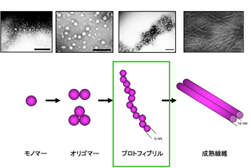
ADは認知症の中で最も多い疾患であり,その発生率は人口の高齢化とともに増大しています。 ADの主な病理学的特徴には, Aβからなる老人斑とタウタンパク質(タウ)からなる神経原線維変化が挙げられます。Aβの凝集・沈着過程は,タウとともにADの病態に大きく関わっていると考えられており(アミロイド仮説),早期あるいは中間凝集段階であるオリゴマーやプロトフィブリル(※3)がADの病因において重要な役割を果たすことが,これまでの研究により示唆されています。しかし,アミロイド凝集過程では単量体,線維に加え,オリゴマーやプロトフィブリルのような準安定な凝集体など,さまざまな凝集体分子種が共在しており,個々の凝集体分子種の構造動態を分析することは困難でした。
本研究では,高速AFMを用いてAβの構造動態を1分子レベルで観察し,Aβプロトフィブリルに多数のレカネマブが取り囲むように結合する様子を動画で捉えることに成功しました。さらに,レカネマブがAβオリゴマーにも結合することで更なる凝集過程を制御することも明らかにしました。また,神経細胞を用いた実験により,レカネマブがAβのプロトフィブリルやオリゴマーに結合することで,プロトフィブリルの神経細胞への毒性,特に細胞膜への直接毒性が軽減することを明らかにしました。
本研究により,レカネマブ の臨床効果の機序の一端を解明することができました。これらの知見は将来,ADを中心とする神経変性疾患のさらなる新規根本治療薬の開発につながることが期待されます。
本研究成果は,2023年5月4日(米国東部時間)に国際学術誌『Nano Letters』のオンライン版に掲載されました。
スケールバー=100 ナノメートル
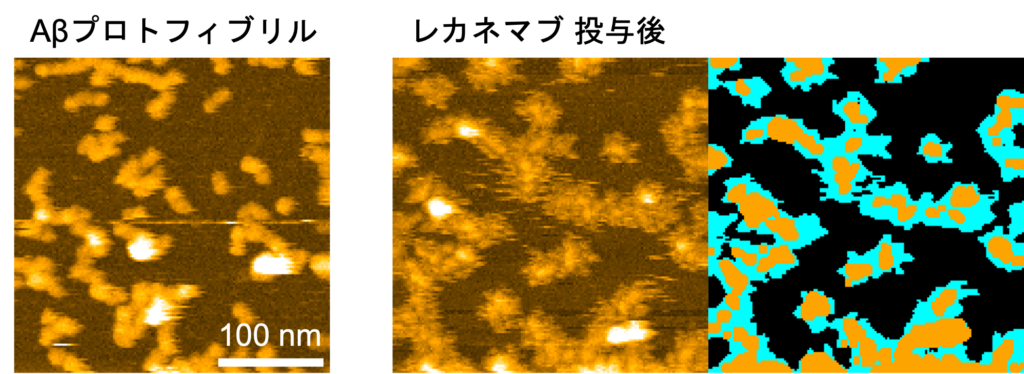
図2:レカネマブ投与後のプロトフィブリルの高速AFM画像(左)と模式図(右:レカネマブ(シアン),凝集体(オレンジ)で覆われた領域)
スケールバー=100 ナノメートル
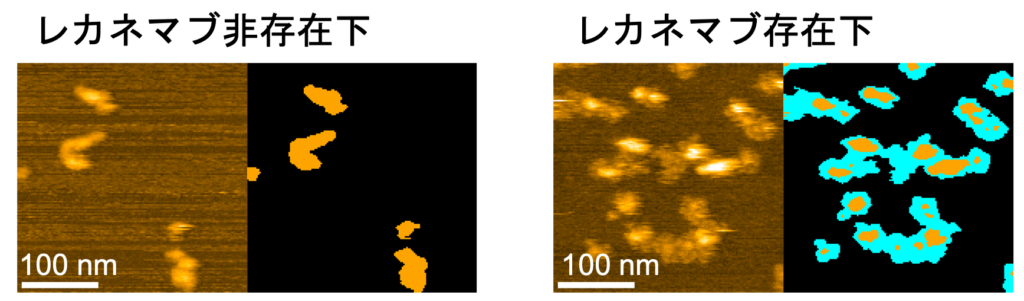
図3:レカネマブ存在下(右)・非存在下(左)の凝集反応の高速AFM画像(左)と模式図(右:レカネマブ(シアン),凝集体(オレンジ)で覆われた領域)
スケールバー=100 ナノメートル
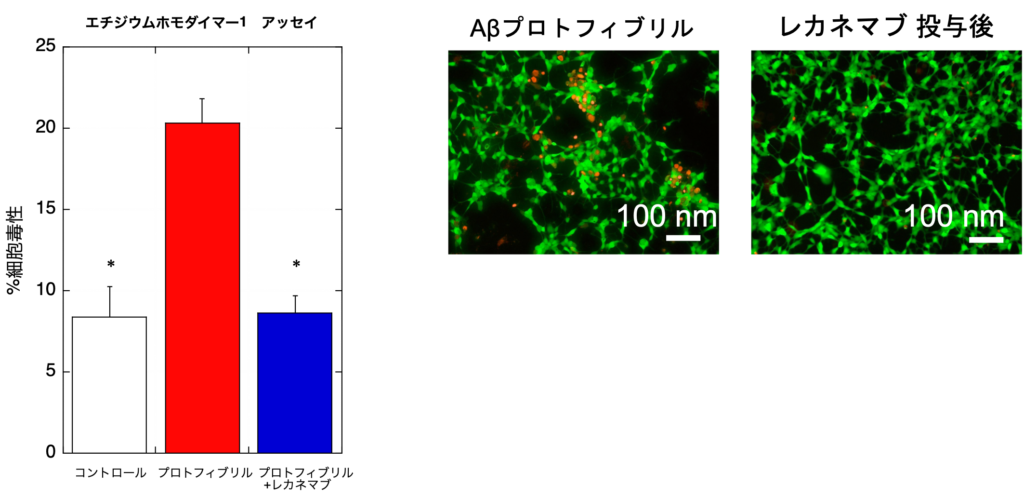
図4:細胞毒性評価(エチジウムホモダイマー1 アッセイと蛍光顕微鏡による細胞写真)
* p < 0.01 :プロフィブリルの細胞毒性(赤)vs. 他の細胞毒性(白,青)
蛍光顕微鏡写真:プロトフィブリルのみでは細胞膜が傷害されて赤の蛍光が目立ちますが,レカネマブ投与後では軽減しています。
図5:レカネマブ 投与後のプロトフィブリルのAβイメージ像
【用語解説】
※1:アルツハイマー病(AD)(Alzheimer’s disease)
認知症をきたす疾患の中で一番患者数が多いと言われています。脳の神経細胞が減って脳が萎縮してしまうために,症状が現れ,徐々に進行していきます。
※2:高速原子間力顕微鏡(高速AFM)
原子間力顕微鏡は,レコードプレーヤーの針がレコード盤の表面の形状をなぞるように,探針(プローブ)と試料間の相互作用を2次元に走査し,試料の起伏の画像を取得する顕微鏡です。ナノメートル(10のマイナス9乗メートル)の空間分解能を持つことに加え,試料は真空中のみならず,空気中,液中と環境を選びません。金沢大学の安藤敏夫特任教授の研究グループは,この原子間力顕微鏡の高速化に成功し,液中でのナノメートル空間分解ビデオ撮影を実現させ,蛍光などの標識無しでタンパク質などの生体分子の構造と動き(動態)を同時に観察することができるようになりました。
※3:プロトフィブリル
75-500Kdの可溶性Aβ凝集体で,Aβの凝集過程(モノマー→線維)における中間段階で高分子オリゴマーの範疇に含まれています。
ジャーナル名:Nano Letters
研究者情報:小野 賢二郎




 PAGE TOP
PAGE TOP