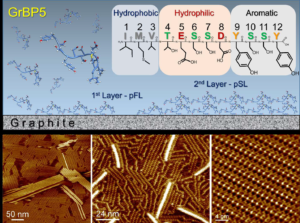
金沢大学ナノ生命科学研究所のアイハン・ユルトセベル特任助教,リンハオ・スン特任助教,福間剛士教授と,米国・ワシントン大学のメフメト・サリカヤ教授の共同研究グループは,周波数変調原子間力顕微鏡(FM-AFM)(※1)を用いて,遺伝子工学的に設計したペプチドがグラファイト表面上で自己組織化(※2)することで一分子の厚さの結晶層を形成することを,液中ナノスケール観察により明らかにしました。
ペプチドはタンパク質と同じくアミノ酸から構成されていますが,タンパク質が数百から数千個のアミノ酸から構成されるのに対し,ペプチドは10~30個と少数のアミノ酸から構成されており,タンパク質と類似の機能を持った小型版として注目されています。しかし,分子が小さいため決まった構造をとらず,その機能の予測も難しいと考えられてきました。
ペプチドは,応用を目的として遺伝子工学的に設計する試みも行われており,中には固体表面で自己組織化するものが存在しています。その詳細な構造や形成過程はほとんど解明されていませんが,もし解明が進めばペプチドの機能予測の手がかりになる可能性があります。そのためには,ナノスケールで,かつ生体分子が機能する液中で計測することが不可欠です。福間剛士教授らにより独自に開発された液中FM-AFM技術は,液中でサブナノスケールのその場観察(※3)が可能な方法です。本研究では,この液中FM-AFM技術を使い,「指向性進化法(※4)」により合成したペプチドが,グラファイト表面に特異的に吸着して自己組織化結晶を形成する様子を捉えることに成功しました。本研究グループによって,液中でのペプチド分子計測手法を確立したことは,ペプチドの機能予測につながり,その生体分子としての機能を活かしてナノデバイス等へ応用する道が拓けます。
これらの知見は,バイオロジーとテクノロジーの両方で用いることができるハイブリッド生体分子ナノデバイスの設計に必要不可欠であり,将来,アミノ酸配列によって制御される機能的な構造を設計するための指針を与え,バイオエレクトロニクス,バイオセンサー,タンパク質アレイなどの複合技術のプラットフォームとなる可能性が期待されます。
本研究成果は,2023年3月1日(米国東部時間)に米国科学誌『ACS Nano』のオンライン版に掲載されました。
【用語解説】
※1 周波数変調原子間力顕微鏡(FM-AFM)
原子間力顕微鏡(AFM)は,鋭く尖った探針を先端に有する片持ち梁、カンチレバーを力検出器として用いて、固体表面近傍を走査することで,表面形状を得ることのできる計測技術である。周波数変調AFMは,カンチレバーをその共振周波数近傍で機械的に振動させ、探針と試料との間に働く相互作用力をカンチレバーの共振周波数変化として検出するAFM動作モードの一つである。液中においてもサブナノスケールの分解能で表面計測が可能である。
※2 自己組織化
目的の性質や機能を持つタンパク質をコントロールされた条件下で作り出す方法。タンパク質に意図的にランダムな変異を導入し,ある性質を持つものを選別することを繰り返し,目的とするタンパク質を得るという,生命の進化を模倣した方法である。
※3 その場観察
実際の反応が起こっている時間・場所で観察を行うこと。in situ 観察とも言う。
※4 指向性進化法
拡散や特異的な結合によって,分子が時間と共に秩序化された安定な構造を形成することを指す。分子間の相互作用は非共有結合的で,外部からの働きかけ無しに起こる現象である。
ジャーナル名:ACS Nano
研究者情報:アイハン・ユルトセベル




 PAGE TOP
PAGE TOP