金沢大学ナノ生命科学研究所/新学術創成研究機構のリチャード・ウォング教授の研究グループは,ナノ生命科学研究所の中山隆宏准教授,古寺哲幸教授,安藤敏夫特任教授,ナノ生命科学研究所/がん進展制御研究所の大島正伸教授の研究グループおよび沖縄科学技術大学院大学(OIST)細胞分子シナプス機能ユニットのローラン・ギヨー博士と共同で,がん細胞の運命を決定する核膜孔複合体(NPC)(※1)の内部構造「バイオフィラメント」のナノ動態を追跡することに成功しました。
核膜における唯一の分子輸送ポアを形成するNPCは,DNAへアクセスするすべての情報を監視する分子ナノゲートとして機能し,がん細胞の異常増殖や転移・浸潤などの悪性形質を促進します。したがって,NPCの作動原理を根本的に理解し制御することで,がんの克服が期待されます。しかし,NPCは30種類のタンパク質から成り立つ高次複合体であり,特に内部構造はフェニルアラニン-グリシン-ヌクレオポリン(FG-NUPs)(※2)に存在する天然変性ペプチド鎖(バイオフィラメント)のランダムな動的相互作用により形成される液-液相分離(LLPS)環境(※3)にあるため,特定の構造を解析することが非常に難しく,バイオフィラメントの動態や機能相関については十分に理解されていませんでした。
今回,本研究グループは,高速原子間力顕微鏡(HS-AFM)(※4)や超解像顕微鏡などの先端バイオイメージング,動態シミュレーション,バイオインフォマティクスやオルガノイド技術(※5)などを駆使した統合解析により,NPCバイオフィラメントの時空間的ナノ動態を追跡することに成功しました。さらに,①大腸がん細胞の発症・悪性化を誘導する転写因子(※6)により,特定のFG-NUPs「NUP214」の発現誘導が促進され,②がん細胞に特異的なバイオフィラメント動態異常を引き起こすことを明らかにしました。
これらの知見は将来,分子レベルでの核膜ナノダイナミクスの理解・制御に基づく新たながん診断・治療法の開発につながることが期待されます。
本研究成果は,2020年6月23日(中央ヨーロッパ時間)に欧州科学雑誌『Biomaterials』のオンライン版に掲載されました。
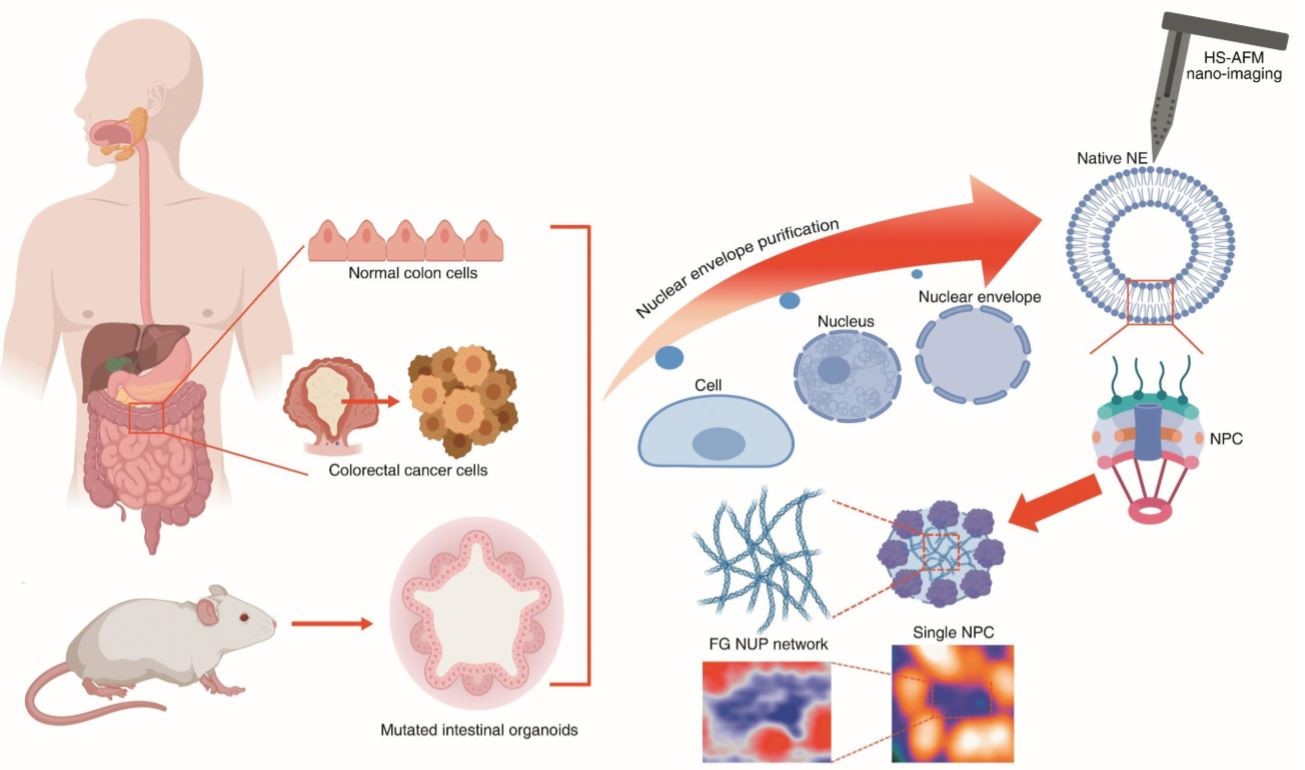
図1. 哺乳類のがん細胞と3Dオルガノイドからのネイティブ核膜孔の操作と追跡の概略図
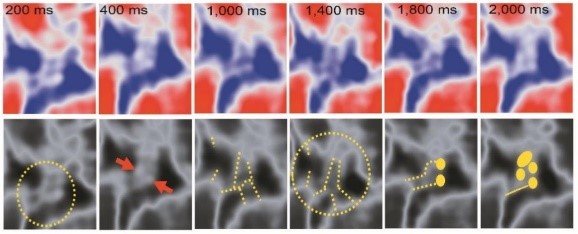
図2. HS-AFMの観察例
核膜孔内の単一ナノフィラメント構造のライブ追跡。核膜孔の中央チャネル内のネイティブシングルFGフィラメント(高さ~1.5 ナノメートル(nm))の急速なコンフォメーション連続変化の一例を示す。
【用語解説】
※1 核膜孔複合体(NPC)
細胞核を覆う膜にある穴である核膜孔を構成するタンパク質の集合体。普段は細胞質と核の間の物質輸送を担う。
※2 フェニルアラニン-グリシン-ヌクレオポリン(FG-NUPs)
アミノ酸の一種であるフェニルアラニンとグリシンの繰り返し配列を持つ核膜孔複合体構成タンパク質。
※3 液-液相分離(LLPS)環境
二つの液体が混ざらずに互いに排除しあい,二相に分離する状態。細胞内にはタンパク質や核酸が局所的に凝集した液滴が多数存在し,これらは液-液相分離(LLPS)環境にある。核内への分子輸送ルートであるNPC内部は,バイオフィラメントの密集により「NPC内部」と「それ以外」を隔てるLLPS環境にある。このLLPSによる条件的相分離により,さまざまな物質が核内へ自由拡散するのを防いでいる。
※4 高速原子間力顕微鏡(HS-AFM)
探針と試料の間に働く原子間力を基に分子の形状をナノメートル(10-9 m)程度の高い空間分解能で可視化する顕微鏡。HS-AFMは,金沢大学ナノ生命科学研究所の安藤敏夫特任教授の研究グループによって開発された超高速で観察できるAFMで,サブ秒(~0.1秒)という時間分解能でタンパク質などの生体分子の形状や動態を観察することができる。
※5 オルガノイド技術
未分化細胞や前駆細胞を三次元的に培養することにより,物理的・生理学的に臓器や組織の特徴を持つ細胞集団を作製する技術のこと。オルガノイドはさまざまな疾患や薬物効果の研究に用いられる。
※6 転写因子
DNAに結合し,DNA情報を活性化する分子の一つ。
研究者情報:リチャード・ウォング
研究者情報:中山 隆宏
研究者情報:古寺 哲幸
研究者情報:安藤 敏夫
研究者情報:大島 正伸




 PAGE TOP
PAGE TOP