金沢大学ナノ生命科学研究所の安藤敏夫特任教授は,名古屋大学,甲南大学,大阪大学,自然科学研究機構の研究グループと共同で,高速原子間力顕微鏡(高速AFM)(※1)により,凝集したタンパク質をほぐして再生する「脱凝集」機能を持つ分子機械(※2)ClpBの動的な構造変化を初めて直接観察することに成功しました。
ClpBはリング状の構造を持つタンパク質で,生命にとって有害な凝集タンパク質をほぐして再生する「脱凝集」機能を持ちます。ClpBは脱凝集の際,ATP(アデノシン3リン酸)(※3)のエネルギーを利用して,リング中央の孔にタンパク質を通すことで脱凝集すると考えられていましたが,その具体的な仕組みは分かっていませんでした。
今回,本共同研究グループは,高速原子間力顕微鏡を用い,ClpBリングの構造変化を直接観察することに初めて成功しました。ClpBリングの構造変化は,ネイティブ質量分析法(※4),電子顕微鏡単粒子解析法(※5),超遠心分析沈降速度法(※6)からも支持され,ClpBのリングはATPの結合・加水分解に応じて,円型・らせん型・ねじれた半らせん型と大きく構造変化することが明らかになりました。また,変異型ClpBを用いた解析により,これらの構造変化が脱凝集を引き起こす原動力となっていること,およびClpBが持つ2つのATP結合部位がそれぞれ固有の役割を担っていることを明らかにしました。
ClpBによる脱凝集の仕組みの一端を明らかにしたことで,凝集タンパク質が原因となる疾患の治療や有用タンパク質の品質維持など医療や産業への貢献が期待されます。
本研究成果は,2018年6月1日午後6時(日本時間)に英国科学誌「Nature Communications」に掲載されました。
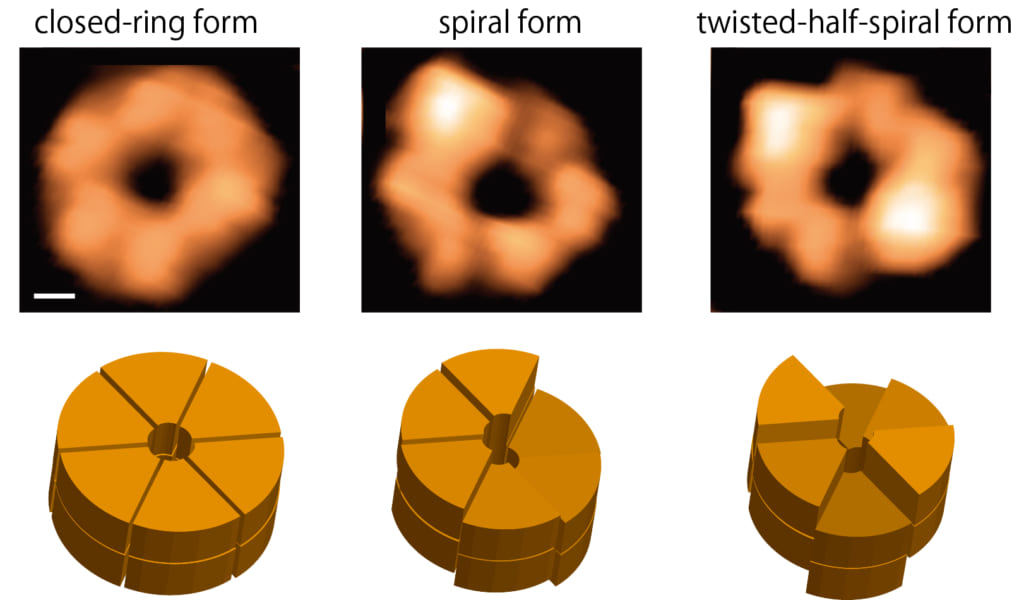
図1 高速AFMによるClpBリングの観察像(上)と模式図(下)
円型,らせん型,ねじれ半らせん型が観察された。上段のスケールバー(白線)は2nm。
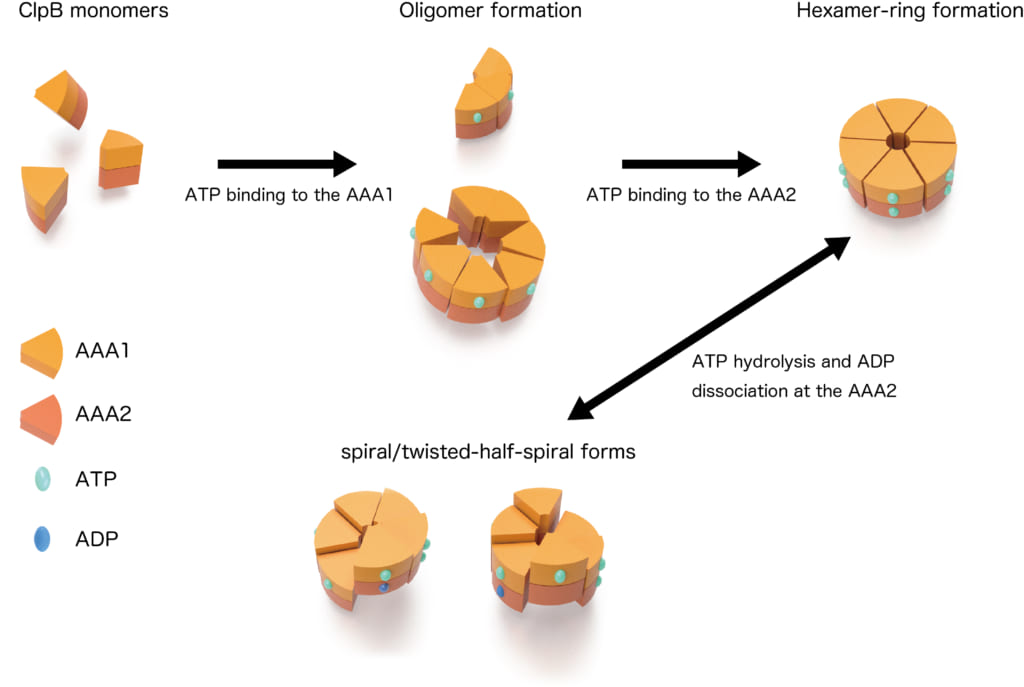
図2 ClpBの動的な構造変化の模式図
【用語解説】
※1 高速原子間力顕微鏡法(高速AFM)
非常に微細な先端を持つ探針で試料表面を高速に走査し,高さの変化として個々のタンパク質の構造変化を実時間で観察する手法。
※2 分子機械
ATP加水分解などの化学エネルギーを機械的な動きに変換し,その動きによって機能を発揮するするタンパク質やタンパク質複合体。
※3 ATP(アデノシン3リン酸)
2つの高エネルギーリン酸結合を持ち,これを切断することで,タンパク質などの他の分子に,機能を発揮させるためのエネルギーを供給する物質。生体内でのエネルギーの貯蔵や輸送に用いられるため,「エネルギーの通貨」に例えられる。
※4 ネイティブ質量分析法
水素結合や疎水性相互作用のような弱い相互作用を保ったまま質量を調べる方法。タンパク質複合体を構成するサブユニットの種類と数が分かる。
※5 電子顕微鏡単粒子解析法
ランダムな向きに分散させた単一粒子試料の像を電子顕微鏡で多数撮影し,個々の粒子像を計算機上で抽出して分類・平均化することにより粒子の高分解能投影像を得る。そして,これを元に単一粒子の三次元構造を再構築する手法。
※6 超遠心分析沈降速度法
溶液に大きな遠心力をかけた際の分子の沈降の様子を超遠心分析装置により観測し,得られた沈降パターンから分子量分布を求める手法。




 PAGE TOP
PAGE TOP