金沢大学医薬保健研究域保健学系の本多政夫教授,金沢大学大学院医薬保健学総合研究科医学博士課程の西川昌志医師,同研究科の岡田光特任准教授,医薬保健研究域医学系の山下太郎教授,医薬保健学総合研究科の金子周一特任教授らの研究グループは,C型肝炎ウイルス (Hepatitis C virus: HCV (※1)) 排除後の肝発がんに寄与する新規遺伝子を発見しました。
HCVは肝臓に持続感染し,慢性肝炎や肝細胞がんの誘因となります。以前のインターフェロン (Interferon:IFN (※2)) 治療ではHCVを完全に排除するウイルス学的持続陰性化 (Sustained Virological Response: SVR (※3)) は約半数程度に得られるのみでしたが,現在の直接作用型抗ウイルス薬 (Direct Acting Antivirals:DAAs (※4)) により極めて高いSVRを達成できるようになりました。しかし,SVR達成により肝発がんのリスクは減少するものの,依然として肝発がんが起こる症例が認められ,SVR後になぜ肝発がんが起こるのかは不明です。本研究グルーブはSVR達成後の肝臓サンプルを用いた網羅的メチル化解析から,SVR後の肝発がんに寄与する機能未知の膜貫通型タンパク遺伝子;TMEM164 (Transmembrane Protein 164) を同定しました。TMEM164は主に血管内皮細胞で発現し,その発現の増強は肝線維化進行や肝がん手術症例の無再発生存率や予後と有意に相関していました (図1)。TMEM164は血管内皮細胞では,血流によって生じるシェアストレス (※5) により誘導され,小胞体ストレス (ERストレス) 応答 (※6) を促していました。以上より,TMEM164を「シェアストレス誘導ERストレス関連膜蛋白」(Shear stress-induced transmembrane protein associated with ER stress signaling:SHERMER)と名付けました。このように本研究グルーブは,C型肝炎ウイルス排除後の肝発がんに寄与する新規膜貫通型タンパク遺伝子SHERMERを同定することに成功しました。
これらの知見は,将来新たな発がん機序の解明や血管内皮を標的にした診断薬や治療薬の開発につながることが期待されます。
本研究成果は,2023年5月3日 に「Cellular and Molecular Gastroenterology and Hepatology」のオンライン版に掲載されました。
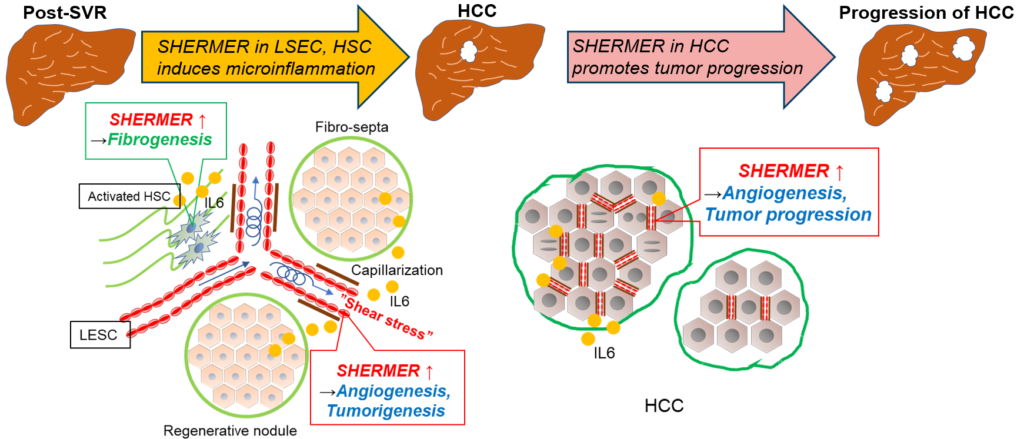
図1
SHERMERは主に肝の血管内皮細胞,活性化星細胞,一部の毛細血管化した肝類洞内皮細胞で発現していました。SHERMERの発現は肝線維化進行と相関していました。また,肝がん組織におけるSHERMERの発現は肝がんの予後不良と関連していました。
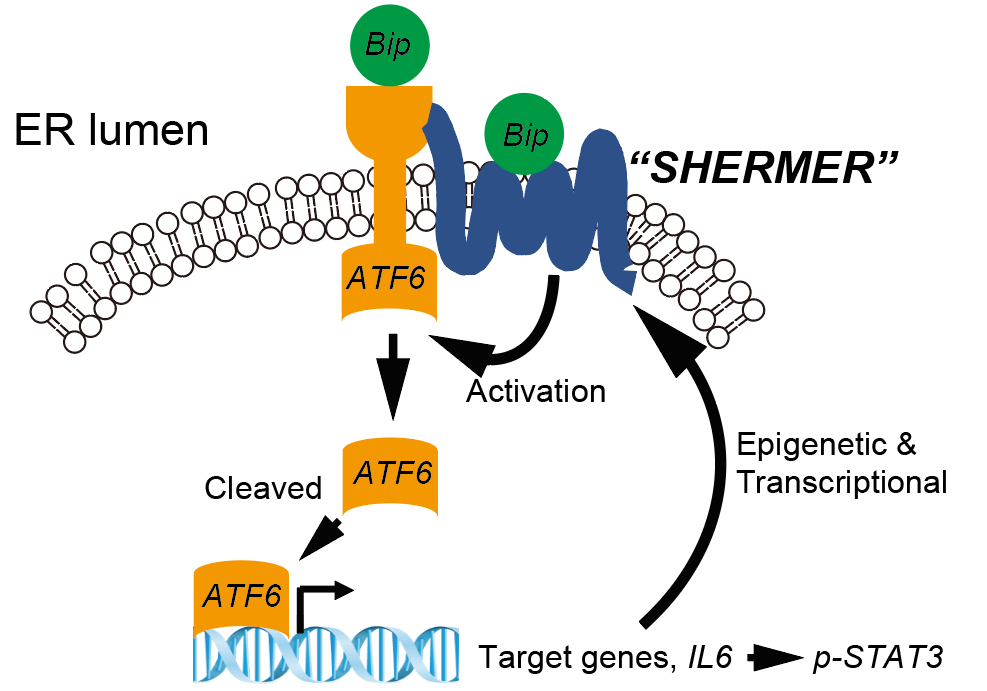
図2
SHERMERはシェアストレスにより誘導され,ERストレスシャペロン分子GRP78/BiPと結合していました。さらにATF6を介したERストレスシグナルを促進することによって,IL6/STAT3シグナルを活性化していました。
【用語解説】
※1:HCV (Hepatitis C virus)
1989年カイロン社により同定されたフラビウイルス科に属する RNAウイルス。HCVに感染すると約70%の人が持続感染者となり,慢性肝炎,肝硬変,肝がんへと進行する。
※2:IFN (Interferon)
哺乳動物におけるサイトカインファミリーの一種で,当初はウイルス感染を抑制する因子として同定された。IFNとリバビリンの併用療法で約半数の症例でHCVの完全排除が行われる。
※3:SVR (Sustained Virological Response)
ウイルス学的持続陰性化。HCVの治療により,血液中のウイルスが陰性化しても,治療後にHCVの再増殖が認められる例が存在する。治療後12週後にもHCVの陰性化が持続していれば,HCVの再燃はないことから,完全に排除されたと判定される。この状態をウイルス学的持続陰性化 (SVR) という。
※4:DAAs (Direct Acting Antivirals)
直接作用型抗ウイルス剤。IFNと異なり直接,HCVを標的とする目的で開発された創薬。第3世代DAAsは副作用が少なく,100%に近いSVR率を達成できるようになった。
※5:シェアストレス
血管壁には,常に血行力学的応力として,血圧による血管壁に垂直に作用する力(stretch) と,血流による血管内腔表面の接線方向に作用する力,壁ずり応力 (wall shear stress) が作用している。内皮細胞が受けるそれらのストレスをシェアストレスという。シェアストレスには血液の粘性と血流の速度が関連し,血管内皮細胞を血流の方向に歪ませる。シェアストレスにより内皮細胞の機能変化が生じる。
※6:小胞体ストレス (ERストレス) 応答
小胞体で変性タンパク質が蓄積することによって引き起こされるストレス応答。PERK (PKR-like endoplasmic reticulum kinase) 経路,IRE1 (Inositol requiring 1) 経路,ATF6 (Activating transcription factor 6) 経路が知られている。
ジャーナル名:Cellular and Molecular Gastroenterology and Hepatology
研究者情報:本多 政夫




 PAGE TOP
PAGE TOP